Как ни разнообразна роль, которую играет озон в атмосфере, эта книга вряд ли бы появилась, если бы не было основной функции озонного слоя — защиты всего живого от ультрафиолетового излучения — и если бы этому слою не грозила реальная опасность.
За последние два десятилетия уже не раз в прессе появлялись сообщения о близкой гибели озонного слоя — «волшебного щита Земли». Поднимался шум, рождалась сенсация, назывались даже сроки катастрофы… И каждый раз более строгие расчеты и более точные измерения «снимали напряжение», уменьшали амплитуду ожидаемого ущерба озонному слою, отодвигали в будущее сроки его реализации.
Значит ли это, что мы можем отнести озонную опасность к категории полумифических? К категории тех реальных или выдуманных явлений вроде летающих тарелок, телепатии, снежного человека, интерес к которым в течение многих десятилетий волнами то появляется, то угасает без заметного следа в развитии человечества.
Нет, конечно нет! Все озонные «сенсации» имели под собой реальную почву и стимулировали более активное изучение тех или иных вопросов физики атмосферы. Именно в результате такой «стимуляции» мы узнали за последние два десятилетия об озоне гораздо больше, чем о любой другой атмосферной компоненте.
Да и изучение структуры, химии, динамики стратосферы в целом продвинулось благодаря интересу к проблеме озона очень сильно.
В этой главе мы расскажем о том, как, в результате каких процессов и аспектов человеческой деятельности может возникать угроза озонному слою, а также о некоторых сенсациях недавнего времени.
Проблема озона действительно стоит сегодня очень серьезно, что угроза заметного разрушения озонного слоя в обозримом будущем реально существует.
Стратосферная авиация и окислы азота
В 1971 г. почти одновременно в научных журналах появились две статьи, посвященные одной проблеме. Одну написал американский ученый Гарольд Джонстон, другую — Пауль Крутцен из ФРГ. Тема обеих статей была одинаковой — угроза слою озона в результате человеческой деятельности.
Рассматривая фотохимические процессы, идущие в стратосфере, Крутцен и Джонстон обратили внимание на цикл из двух реакций:
O3 + NO → NO2 + O2
NO2 + O → NО + O2 (7)
Чем же интересны эти реакции? А вот чем. Посмотрите на их левые части. Погибла одна молекула окиси азота и одна молекула двуокиси азота. А что в правой части? Появилось также по одной молекуле NO и NO2. Значит, расхода ни окиси, ни двуокиси азота в этих двух реакциях не происходит, эти вещества являются катализаторами.
Что же тогда происходит? Вновь посмотрим на левые и правые части реакций. Исчезли (вступили в реакцию) атом O и молекула O3, а образовались две молекулы O2. Если записать то, что произошло, в виде одной (результирующей) реакции, то, очевидно, можно получить
O + O3 → O2 + O2 (8)
«Постойте, постойте! — воскликнет внимательный читатель. — Но ведь эта реакция уже встречалась в первой главе, где говорилось о фотохимии озона!» Совершенно верно. И мы подчеркивали там роль этой реакции в установлении равновесной концентрации озона. Ведь эта реакция «одним махом» уничтожает и сами молекулы O3 и атомы O, которые нужны для создания озона.
Отличие системы реакций (7) от реакции (8), или — что то же — (5), в том, что эффективность системы зависит от концентрации окислов азота NO и NO2, выступающих в роли катализатора. Очевидно, что при достаточно высоких концентрациях NO и NO2 скорость гибели O и O3 в результате действия системы может стать во много раз выше, чем по реакции (8). Но эта реакция играет в атмосфере важную роль и определяет, как мы уже говорили, равновесную концентрацию озона. Значит, если эффект системы (7) сильнее эффекта реакции (8), то концентрация O3 будет определяться уже скоростью гибели O и O3 в этой системе и будет меньше, чем в случае действия только реакции (8). Насколько меньше? Это зависит только от того, сколь велики будут концентрации NO и NO2. Очевидного предела здесь нет.
Таково упрощенное изложение основной идеи Крутцена и Джонстона. Ясно, что если в результате деятельности человека количество окислов азота в стратосфере возрастет выше определенного уровня, равновесная концентрация озона начнет падать.
Отметим сразу, что в принципе неважно, какие конкретные окислы азота (NO, NO2, N2O) будут попадать в атмосферу. В ходе быстрых реакций с кислородными соединениями, например типа тех же реакций (7), между окислами азота установится внутреннее соотношение, поэтому для проблемы разрушения озона существенно лишь суммарное количество всех попадающих в атмосферу азотных соединений. Обозначим их условно NOx.
Естественно встает вопрос о том, какого рода деятельность может привести к заметному росту количества NOx в стратосфере? На самом деле источников азотного загрязнения довольно много, и мы поговорим о них ниже в этом параграфе. Но Крутцен и Джонстон сделали акцент на одном из них — на полетах стратосферной авиации.
Дело в том, что при полете реактивного самолета в стратосферный воздух выбрасывается большое количество отработанных газов из двигателей, существенную часть которых составляют окислы азота и пары воды.
В то время (самое начало 70-х годов) многие государства планировали активное развитие сверхзвуковой стратосферной авиации. Уже проходили испытания англо-французский «Конкорд» и наш «Ту-144», были планы выпуска стратосферных лайнеров в США…
Прикинув тенденцию будущего развития стратосферной авиации, Крутцен и Джонстон оценили ожидаемое количество полетов на рубеже 80-х годов в несколько сот в сутки. Задавшись далее некоторыми исходными данными о количестве выбрасываемых в окружающий газ окислов азота за один полет, они получили общее число молекул NOx, которое в результате окажется в стратосфере. Итог получился сенсационным. Оказалось, что попавшего таким образом в стратосферу количества окислов азота будет достаточно, чтобы уже в начале 80-х годов равновесная концентрация озона уменьшилась в результате действия системы реакций (7) на несколько десятков процентов! Из того, что мы говорили в предыдущих главах, ясно, что это — очень большая величина. Именно поэтому статьи Крутцена и Джонстона вызвали настоящую сенсацию, а их оценки и прогнозы быстро перекочевали из научных журналов на страницы общедоступной прессы.
В 1972—1975 гг. в США частично под влиянием вызванного Крутценом и Джонстоном ажиотажа в прессе, частично из соображений коммерческой политики (подавить конкурентов на мировом авиационном рынке) была разработана большая специальная программа исследований, посвященных климатическим эффектам воздействия полетов стратосферной авиации (сокращенно СИАП). В рамках этой программы были проведены многочисленные эксперименты и модельные расчеты. Они показали, что даже при ожидавшемся тогда большом числе полетов стратосферной авиации уменьшение озона в стратосфере должно быть очень малым, а при полетах на высотах тропопаузы и ниже концентрации O3 могут даже несколько возрастать.
Мы с вами, уважаемый читатель, давно оставили позади «начало 80-х годов». И предсказанного Крутценом и Джонстоном катастрофического уменьшения озонного слоя пока действительно не наблюдается. Значит ли это, что Крутцен и Джонстон были не правы? Нет, и тысячу раз нет. Они были правы уже в том, что поставили вопрос и показали, насколько реально нанести ощутимый ущерб слою озона даже в ближайшем будущем. Наше общее счастье, что их прогнозы в количественном плане не подтвердились.
Это случилось по нескольким причинам. Во-первых, не произошло ожидавшегося бума с развитием стратосферных полетов. Во-вторых, оказались неверными некоторые из использовавшихся Крутценом и Джонстоном исходных данных о количестве выбрасываемых молекул NOx и о скоростях ряда фотохимических реакций. Подробный разбор исходных предположений Крутцена и Джонстона на страницах этой книги неуместен. Отметим лишь еще раз, что их огромная заслуга состоит в том, что они привлекли внимание мировой общественности к проблеме антропогенного разрушения озона и стимулировали в последующие годы бурный рост исследований как в области фотохимии озона, так и в области загрязнения стратосферы. И сегодня мы уже ясно понимаем всю глубину указанной проблемы, хотя ближайшая опасность грозит озону не со стороны выбросов стратосферной авиации, а со стороны так называемых фреонов, о которых речь впереди.
Упомянем еще одну существенную сторону работ Крутцена и Джонстона. Они фактически положили начало детальному изучению химии стратосферы и, в частности, подчеркнули ту важную роль, которую играют в ней малые примеси — азотные и водородные соединения. Основой для их выводов служили чисто модельные расчеты распределения концентрации этих соединений, и впоследствии большинство расчетов подтвердилось достаточно дорогостоящими измерениями с помощью сложных приборов.
По мере изучения проблемы опасных для озона антропогенных загрязнений выяснилось, что выбросы стратосферных самолетов не являются единственным (и даже главным) искусственным источником поступления азотных окислов в атмосферу. Очень мощным источником NOx являются азотные удобрения.
В наш урбанистический век идет мощная индустриализация сельского хозяйства. Проявляется она, в частности, и во все более интенсивном использовании химических удобрений, в первую очередь азотистых соединений. Попадая в почву, такие удобрения (прежде всего это закись азота N2O) распыляются, при этом некоторое количество молекул попадает в приземный воздух.
Конечно, от попадания молекул N2O в приземную атмосферу до повышения концентрации NOx в стратосфере путь длинный. Целая цепочка процессов — турбулентность в приземном слое воздуха, восходящие движения в тропосфере, перенос обогащенного азотными окислами газа в низкие широты, восходящие потоки из тропосферы через тропическую тропопаузу в стратосферу, обратный горизонтальный перенос газа в более высокие широты уже в стратосфере — должна произойти, чтобы в результате над всем земным шаром увеличилось количество молекул NOx, представляющих угрозу для стратосферного озона.
Но, сколь ни труден путь молекул NOx из приземного слоя атмосферы на стратосферные высоты, он существует и ежедневно с огромной площади обработанных удобрениями полей по этому пути устремляются вверх все новые и новые миллиарды молекул азотных окислов…
Увеличение количества используемых азотистых удобрений идет быстрыми темпами. За 20 лет с 1955 по 1975 г. производство таких удобрений возросло более чем в 10 раз (примерно с 3 до 40 миллионов тонн (мегатонн) в год). К настоящему моменту эта величина выросла еще примерно в пять раз и к 2000 г. можно ожидать, что она вырастет еще вдвое. Оценки начала 80-х годов показывают, что за счет использования азотистых удобрений в атмосферу поступает ежегодно около 10 мегатонн N2O и что эта величина составляет 25—40% естественного поступления закиси азота.
Наконец, окислы азота поступают в атмосферный газ (главным образом в виде N2O) при сжигании промышленного топлива. По имеющимся оценкам, количество закиси азота, попадающее в воздух с дымом работающих на обычном (не ядерном) горючем электростанций, само по себе достаточно велико и составляет 3—4 мегатонны в год. Однако на фоне быстро растущего выброса N2O из-за использования азотистых удобрений последняя цифра представляется уже не такой грозной. К тому же можно надеяться, что эта величина не будет существенно расти в ближайшие десятилетия благодаря набирающей во всем мире силу тенденции перехода на экологически чистую энергетику.
Результаты активного использования человечеством окислов азота не заставили себя ждать. Измерения показывают, что количество N2O в атмосфере (и, в частности, в стратосфере) растет со скоростью примерно 0,2% в год. Это значит, что, если такой темп сохранится, количество закиси азота в атмосфере удвоится через 300 лет. А если темп этот заметно возрастет?..
Ядерное облако и озон
Существует еще один антропогенный источник азотных окислов, который может влиять на жизнь стратосферного озона. Речь идет о высотных ядерных взрывах.
За счет сильного нагрева газа (в тепловую энергию переходит около трети всей энергии взрыва) и частично за счет мощного излучения состав воздуха в области взрыва сильно изменяется — в нем появляется много азотных окислов. Сама вспышка излучения длится очень недолго, да и падение температуры после внезапного нагрева происходит достаточно резко. Однако быстро вернуться назад к исходному состоянию газ с измененным составом уже не может — время жизни относительно динамических и химических процессов составляет часы. В результате облако с высокой «добавкой» азотных окислов будет, постепенно расширяясь, существовать довольно большое время (некоторое превышение концентрации NOx над нормальным значением может наблюдаться и через сутки после взрыва).

Состав воздуха, в области взрыва сильно изменяется — в нем появляется много азотных окислов
По разным оценкам, при взрыве образуется от 1 до 10 килотонн NOx на 1 мегатонну мощности. На первой стадии в облаке присутствует в основном двуокись азота NO2. Именно ей облако обязано своим желтоватым цветом. При остывании облака происходит перераспределение азотных радикалов и в облаке появляются другие окислы, прежде всего NO. На стадии, когда горизонтальный диаметр облака составляет несколько километров, концентрация молекул NOx в нем равна примерно 1012 см-3. Легко видеть, что эта величина близка к концентрации самого озона в максимуме его слоя. Как азотные окислы поступают с озоном, мы уже знаем. Значит, неизбежно заключение о том, что атомные взрывы должны разрушать стратосферный озон. А что на самом деле?
При обсуждении влияния высотных ядерных взрывов на озон нужно различать кратковременные и долговременные эффекты. Вряд ли можно ожидать, что в облаке, насыщенном окислами азота, количество озона сохранится неизменным. Оценки по теоретическим моделям дают уменьшение концентрации озона в области максимума слоя в 3—30 раз в зависимости от параметров взрыва. Измерить, однако, такие эффекты по понятным причинам трудно. Кроме того, к нашему счастью, в последние полтора десятилетия высотные взрывы не проводятся (основная серия была в 60-х годах), и поэтому нет возможности проверить теоретические оценки изменения концентрации озона с помощью наблюдений современными методами.
Серии высотных ядерных испытаний 60-х годов, по оценкам, привели в сумме к образованию в стратосфере дополнительно большого количества окислов азота, сравнимого с их естественным источником. Так, в 1961 г. ядерный источник NOx дал примерно 600 килотонн, а в 1962 г.— 1100 килотонн, что лишь немного меньше естественного поступления NOx — 1600 килотонн в год. Казалось бы, такая «добавка» к обычному фону азотных соединений не могла сказаться на количестве озона в эти годы в глобальном масштабе. Однако все попытки найти по мировой сети озонометрических станций тех времен следы какого-либо систематического уменьшения N (O3) в этот период не дали определенного результата. Более того, по некоторым данным количество озона в последующие годы даже возросло. Не удалось обнаружить глобальных эффектов в N (O3) и после высотных ядерных взрывов весной 1970 г., хотя тогда уже велись наблюдения N (O3) со спутника «Нимбус-4».
Все эти данные поставили под сомнение даже сам факт отрицательного влияния высотных ядерных взрывов на количество озона и позволили некоторым ученым высказать предположение, что в результате всего комплекса процессов, происходящих в облаке, количество озона может не уменьшаться, а возрастать.
Более реальным все-таки, с позиции наших сегодняшних знаний о физике стратосферного озона, представляется уменьшение концентрации озона в результате взрыва. Однако, каков бы ни был правильный ответ, памятуя, что речь идет о ядерном оружии, будем надеяться, что мы никогда больше не получим возможности проверить в этом вопросе теорию экспериментом.
Озон во влажной атмосфере
Развитие работ по изучению озона и его дальнейшей судьбы после «самолетного бума», описанного выше, пошло очень быстро. В ряде стран были созданы специальные лаборатории и даже целые институты, занимающиеся озонной проблемой. При многих международных организациях (и чисто научных, и правительственных, таких, как Всемирная метеорологическая организация — ВМО) были организованы комиссии, советы, рабочие группы для координации усилий ученых разных стран, проведения совместных программ наблюдений и выработки рабочих документов, суммирующих наши знания об озоне и его судьбе на тот или иной момент. Отметим сразу, что такое положение сохраняется и по сей день и что в самое последнее время в связи с ажиотажем вокруг «озонной дыры» активность международных озонных органов заметно возросла.
Одним из немаловажных результатов интенсивного изучения озона и его фотохимии явилось установление того факта, что каталитический цикл разрушения озона типа реакций (7) возможен при участии не только окислов азота, но также и окислов водорода.
В последнем случае этот цикл выглядит так:
OH + O3 → HO2 + O2
HO2 + O → OH + O2 (9)
Не правда ли, все как с азотом, только с водородом. И смысл тот же: молекула гидроксила OH погибла — молекула перекиси водорода HO2 образовалась, молекула HO2 погибла — молекула OH восстановилась. Убыли ни HO2, ни OH нет. А молекулы O3 и атомы O гибнут.
Итак, разрушение озона в атмосфере возможно и в каталитических реакциях с участием окислов водорода. К циклу процессов с участием соединений азота (азотный цикл) добавляется еще и цикл водородный. В последнем (как и в случае азотного цикла) участвует много водородсодержащих соединений, которые обозначают обычно как семейство HOx. Конечно, реально каждый из этих циклов насчитывает многие десятки реакций, идущих при взаимодействии членов азотного и водородного «семейств» между собой, с тремя аллотропами кислорода (O, O2 и O3) и с членами других семейств. Попытка привести здесь все эти реакции, или хотя бы описать их, сильно усложнила бы наш рассказ. Мы ограничимся поэтому лишь конечными (с точки зрения нашего обсуждения судьбы озона) этапами обоих циклов — реакциями (7) и (9), но просим читателя иметь в виду, что катализаторы в виде окислов NO, NO2, ОН и НО2 существуют в атмосферном газе в результате действия многочисленных реакций с участием в первую очередь тех химических реагентов, которые непосредственно поступают в атмосферу в виде продуктов естественных процессов или загрязняющих веществ.
В каком же виде водород поступает в атмосферу? Прежде всего, в виде наиболее распространенного на Земле вещества — воды. То, что окружающий нас воздух может быть буквально насыщен влагой, каждый знает из своего опыта. Вода играет важную роль в состоянии тропосферы, именуемом погодой, и последняя часто определяется именно перемещением влажных и сухих масс воздуха.
Но путь молекул воды из тропосферы в стратосферу отнюдь не прост. Законы атмосферной динамики таковы, что переноса масс воздуха через тропопаузу практически не происходит. Поэтому и молекулы малых составляющих (будь то закись азота, о которой мы говорили в предыдущем параграфе, вода, о которой мы ведем рассказ здесь, или фреоны — предмет нашего дальнейшего рассказа) попасть в стратосферу из тропосферы, просто двигаясь вверх, не могут. Исключение составляет очень холодная и высокорасположенная (17—18 км) тропопауза тропических широт, где такой перенос происходит. В результате молекулы реагентов, попавших в тропосферу в средних широтах, должны проделать длинный путь: сначала в тропосфере к экватору (горизонтальный перенос), затем через тропическую тропопаузу (вертикальный перенос) и, наконец, назад в средние широты уже на стратосферных высотах (горизонтальный перенос). Небольшим, видимо, добавлением к описанному механизму служит проникновение в стратосферу мощных кучевых облаков, которые иногда «пробивают» тропопаузу и возносят свои башни на несколько километров в стратосферу. В этом случае перемещение воздуха внутри облаков забрасывает некоторое количество тропосферного газа со всеми содержащимися в нем малыми примесями непосредственно в стратосферу.
В результате описанных процессов в стратосферу регулярно поступают молекулы Н2О, которые затем разрушаются под действием солнечного ультрафиолетового излучения (фотодиссоциация) или в результате химических реакций и образуют HO и HO2. Эти процессы и формируют равновесные концентрации паров воды в стратосфере. Если в тропосфере, как мы знаем из опыта, количество паров воды в воздухе меняется очень сильно, то в стратосфере относительная концентрация η паров воды довольно стабильна и на высотах 15—30 км составляет (3—4) ∙ 10-6 (три-четыре молекулы воды на миллион молекул воздуха). Впрочем, такая стабильность характерна лишь для низко- и средне- широтной стратосферы. В полярных областях η (H2O) на тех же высотах меняется в несколько раз.
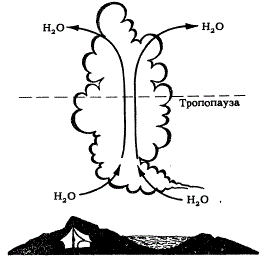
Перемещение воздуха внутри кучевых облаков забрасывает тропосферный газ со всеми примесями непосредственно в стратосферу
Человеческая деятельность также привносит воду в верхние слои атмосферы. При подъемах крупных ракет (типа «Атлас») в атмосферный газ выбрасывается большое количество молекул H2O. Известны случаи, когда в ионосфере на высотах 200—300 км образовывались в результате этого «дыры» — области с сильно пониженной концентрацией электронов — диаметром в сотни километров. Происходит выброс воды (наряду с NO) и при полетах стратосферной авиации. Но оценить вклад всех этих процессов в общий баланс H2O в атмосфере сегодня трудно.

Природный источник метана — влажные леса, болота и рисовые поля
Вторым веществом, с помощью которого водород попадает в атмосферу, является метан CH4. Природный источник метана — влажные леса, болота и рисовые поля, где он образуется в основном как результат деятельности анаэробных бактерий. Заметный вклад в общее поступление метана вносят и жвачные животные (крупный рогатый скот).

Антропогенным источником метана является добыча нефти и природного газа
До середины 70-х годов считалось, что количество метана в атмосфере достаточно стабильно и составляет примерно одну молекулу СН4 на миллион молекул воздуха, то есть η (СН4) = (1,1—1,2) ∙ 10-6, во всем интервале высот от 0 до 35—40 км.
Однако метан попадает в атмосферу не только благодаря деятельности анаэробных бактерий. Антропогенными источниками метана являются выбросы из угольных шахт (рудничный газ), а также добыча нефти и природного газа. По различным оценкам, из этих источников в атмосферу ежегодно поступает метана от 16 до 210 мегатонн, что составляет заметную часть общего его поступления (440—850 мегатонн в год). В последние десятилетия стало ясно, что начиная еще с XVIII в. происходит рост количества метана в атмосфере. В результате хозяйственной деятельности человека количество метана в атмосфере уже к середине 80-х годов выросло по сравнению с приведенной выше цифрой на 30—40%, и сегодня оно ежегодно увеличивается на 1—2%.
Эти проклятые фреоны
К середине 70-х годов уже стало ясно, что две группы химических соединений антропогенного происхождения (семейство азота и семейство водорода) ведут войну со стратосферным озоном. В 1974 г. американские ученые Молина и Роуленд привлекли внимание мировой научной общественности к возможности протекания наряду с реакциями (7) и (9) также каталитического цикла:
Cl + O3 → ClO + O2
ClO + O → Cl + O2 (10)
Подробно объяснять читателю, что здесь происходит, вероятно, уже нет нужды. Атом хлора и молекула ClO являются катализаторами, а гибнут все те же атомы O и O3 молекулы . При этом важно, что скорость распада озона на одну молекулу Cl или ClO примерно в шесть раз выше, чем на одну молекулу NO или NO2.
Первоначально значение этого цикла было неясно. Откуда в атмосфере хлор? Азот — да, водород — конечно, поскольку мы привыкли к водородным и азотным соединениям в атмосфере. Но хлор? Оказалось, однако, что именно хлорный цикл разрушения озона представляет наиболее реальную опасность для жизни озонного слоя. Развитие цивилизации приводит ко все более убыстряющемуся выбросу хлорных соединений в атмосферу, и одну из ведущих ролей в этом процессе играют так называемые фреоны.
Фреоны представляют собой хлорфторуглеродсодержащие соединения (хлорфторуглеводороды). Они появились еще в 20-х годах при развитии холодильной техники как хороший (недорогой и неядовитый) заменитель использовавшегося прежде аммиака. В дальнейшем фреоны получили широкое распространение при производстве различных аэрозолей (деодорантов, лаков, инсектицидов и т. д.), а также в других областях техники (смазки, антикоррозийные покрытия, изготовление пенопластов и т. д,). Список используемых в настоящее время фреонов весьма длинен, и их описание заняло бы много места. Мы укажем здесь для примера два наиболее распространенных фреона — F-11 (CFCl3) и F-12 (CF2Cl2). В нумерации фреонов зашифрована их химическая формула, поэтому наряду с F-11 и F-12 существуют, например, F-22, F-114, F-116 и т. д. К фреонам относят также фторуглеродные соединения, в которые вместо хлора входит бром. Так, в списке фреонов есть, например, F-13B1 (CF3Br).
Рост производства фреонов во второй половине нашего века идет огромными темпами. За период с 1956 по 1975 г. промышленный выпуск F-11 вырос почти в 50 раз, F-12 — в 20 раз. Соответственно, быстро растет и количество фреонов, попадающих в атмосферу. Так, с 1950 по 1980 г. выброс F-11 вырос примерно в 300 раз, a F-12 — более чем в 10 раз.

Фреоны нашли широкое распространение в холодильной технике, а также в качестве основы (распылителя) в различных аэрозолях
В ходе изучения возможности разрушения озона под действием хлорного цикла выяснилось, что фреоны не являются единственным источником антропогенного хлора в атмосфере. Мировая химическая промышленность выпускает в больших количествах и другие хлорсодержащие соединения. К ним прежде всего относятся четыреххлористый углерод CCl4 и дихлорэтан CH2Cl—CH2Cl. Эти вещества являются промежуточными соединениями при многих важных промышленных процессах, и их поступление в атмосферу связано в основном с технологическими потерями. В настоящее время их вклад в загрязнение атмосферы (и, соответственно, в разрушение озона) значительно уступает вкладу фреонов. Однако, забегая вперед, отметим, что при принятии на международном уровне эффективных мер по резкому уменьшению производства и использования фреонов, роль других хлорсодержащих веществ возрастет. Фактически (при нереальном предположении, что выпуск фреонов прекращен полностью) такие вещества, как четыреххлористый углерод, дихлорэтан, хлористый этил и т. д., станут ограничителем наших возможностей уменьшить выброс хлора в атмосферу, поскольку они завязаны в большом числе процессов, от которых промышленность ближайшего будущего вряд ли может отказаться.
Но вернемся к нашим… фреонам. Что будет с молекулами CFCl3 (F-11) или CF2Cl2 (F-12), когда они после долгого пути доберутся наконец до стратосферы? На них будет действовать солнечное ультрафиолетовое излучение, в результате чего, как обычно, произойдет фотодиссоциация (разрушение) молекул фреонов. Это разрушение происходит таким образом, что отрывается один атом хлора. Остающиеся радикалы (CFCl2 в случае F-11 и CF2Cl в случае F-12) легко окисляются имеющимися в избытке молекулами кислорода, давая молекулу окиси хлора и новый (устойчивый) радикал.
Таким образом, в результате диссоциации одной молекулы фреона образуются две активные хлорсодержащие частицы — атом Cl и молекула ClO. Обе они, как мы видели, активно включаются в каталитический цикл (10) разрушения озона.
Поскольку мы уже говорили о бурном росте промышленного производства фреонов, вполне уместен вопрос: а отразилось ли это на концентрациях фреонов в атмосфере и, особенно, в стратосфере? Ответ, к сожалению, звучит утвердительно: да, отразилось.
Атмосфера не может остаться неизменной при таком нашествии фреонов, и их концентрация в атмосферном газе неуклонно растет. Например, за тот же период 1970—1980 гг. относительная концентрация фреона-11 возросла в стратосфере в четыре раза, а фреона-12 — в три. И хотя молекул фреонов все еще, по нашим обычным понятиям, очень мало — всего три—пять молекул F-11 или F-12 на десять миллиардов молекул воздуха — η (F) = (3—5) ∙ 10-10, — они уже сейчас могут принести слою озона существенный ущерб. А что же будет в будущем?..
О том, что означает для судьбы стратосферного озона такое увеличение содержания фреонов, будет подробно рассказано в последующих главах. Сейчас отметим только, что при составлении прогнозов изменения количества озона в ближайшие десятилетия наиболее остро стоит вопрос именно о прогнозировании роста концентраций хлора и хлорсодержащих соединений. Доказательством же того, что роет выброса фреонов сказывается уже сейчас, служит, с большой вероятностью, феномен «озонной дыры» над Антарктидой.
Реальность опасности дальнейшего роста выбросов хлорсодержащих соединений в атмосферу потребовала принятия серьезных мер на международном уровне. По инициативе ученых ведущие государства мира, включая и СССР, подписали в 1988 г. так называемый Монреальский протокол, согласно которому в ближайшие годы должно быть резко сокращено использование наиболее опасных долгоживущих фреонов, в том числе F-11 и F-12.
Почему долгоживущих? Дело в том, что у одной молекулы фреона (равно как и молекул N2O и H2O и т. д.) путешествие из среднеширотной тропосферы в среднеширотную стратосферу занимает около года. Если молекула «проживет» этот год (то есть не будет разрушена под действием солнечного излучения или химических реакций), стратосферный газ пополнится двумя частицами активного хлора. Если же ее время жизни меньше, она разрушится еще по пути и продукты разрушения будут вымыты вниз на поверхность Земли дождями. Ущерба стратосферному озону не будет.
Фреоны-11 и 12 — долгожители. Их время жизни составляет примерно 70 и 100 лет соответственно. Именно поэтому увеличение их выбросов в атмосферу столь опасно для героя нашей книги — озона. А вот если заменить их на более короткоживущие соединения (пусть даже тоже фреоны), на судьбу стратосферного озона они влиять не будут.
Ряд промышленно развитых стран (например, Япония) уже объявили о полном отказе от использования долгоживущих фреонов и переходе на короткоживущие (время жизни существенно меньше года). Однако в развивающихся странах такой переход (требующий, естественно, серьезного обновления ряда областей промышленности и хозяйства) встречает понятные трудности, поэтому реально вряд ли можно ожидать полного прекращения в обозримые десятилетия выброса долгоживущих фреонов, а значит, и проблема сохранения озонного слоя будет стоять очень остро.
Итак, мы теперь знаем, что у стратосферного озона есть целых три врага — три фотохимических цикла (азотный, водородный и хлорный), три семейства радикалов NOx, HOx и ClOx, ряды которых непрерывно пополняются за счет выброса в атмосферу все новых и новых порций загрязняющих веществ.
Казалось бы, под дружным натиском трех врагов слой озона давно должен был бы пасть. Но, к счастью для нас с вами, дорогие читатели, натиск этот не такой дружный. Или даже, совсем не дружный. Эффект действия трех циклов не равен сумме эффектов от отдельных циклов. Протекающие между членами различных семейств реакции (например, между NO2 и ClO) как бы отвлекают химически активные радикалы от взаимодействия с озоном. Так, цикл реакций окисления метана сильно влияет в верхней, стратосфере на количество свободного хлора, а реакция NO2 с ClO, дающая неактивный по отношению к озону ClONO2, ослабляет влияние на озон обоих циклов — и азотного, и хлорного.
Но, несмотря на такие «разногласия» в стане врагов озона, над ним (а это значит — над всеми нами) нависла реальная опасность. Концентрации всех трех семейств NOx, HOx и ClOx в стратосфере неуклонно растут, и в результате увеличивается скорость разрушения озона в химических реакциях. Следовательно, неизбежно должна падать равновесная концентрация O3.
Источник: А.Д. Данилов, И.Л. Кароль. Атмосферный озон — сенсации и реальность. — Л.: Гидрометеоиздат, 1991
