Чистая, дистиллированная вода почти совершенно не проводит электрического тока.
Она обладает огромным сопротивлением. Например, сопротивление кубического сантиметра дважды перегнанной воды равно сопротивлению медной проволоки сечением в квадратный миллиметр, длина которой равна примерно 200 тысячам километров. Таким количеством проволоки можно больше чем 20 раз соединить между собой Москву и Владивосток. Для электролиза дистиллированная вода не годится. Нужна такая вода, которая бы хорошо проводила электрический ток, то есть была бы электропроводной.
Чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Большинство химических соединений, растворяясь в воде, распадаются на части, которые приобретают при этом тот или иной заряд. Образующиеся заряженные частицы называются ионами, а разложение вещества на ионы — электролитической диссоциацией.
Обыкновенная поваренная соль (NaCl) при растворении в воде распадается на ион натрия (Na+), заряженный положительно, и ион хлора (Сl—), заряженный отрицательно. Ионы натрия и хлора, имеющие только по одному заряду, называются одновалентными ионами. Ионы, которые имеют два или три заряда, называются двух- или трехвалентными. В качестве примера двухвалентного иона можно привести ион кальция (Са). Хлористый кальций (СаСl2), диссоциируя на ионы, дает два одновалентных отрицательных иона хлора (2Сl) и один двухвалентный ион кальция (Са), заряженный положительно. Треххлористое железо (FeCl3) при диссоциации на ионы дает три одновалентных отрицательных иона хлора (3Сl—) и один трехвалентный положительный ион железа (Fe+++).
Итак, при электролитической диссоциации соли образуются отрицательно заряженные ионы, которые называются анионами, и положительно заряженные ионы — катионы.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток. Серная кислота (H2SO4) распадается на два положительно заряженных иона водорода (2Н+) и кислотный остаток — анион (SO4—), обладающий двумя отрицательными зарядами.
Щелочи при диссоциации образуют положительный ион металла и отрицательный ион гидроксила. Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две металлические пластинки и подключить к ним постоянный ток от аккумулятора, то положительные ионы — катионы — сразу же начнут передвигаться к отрицательному электроду, который называется катодом, а отрицательные ионы — анионы — направятся к положительному полюсу — аноду. Находящиеся у электрода анионы отдадут ему свои отрицательные заряды — электроны (е) — и разрядятся. В то же самое время разрядятся и катионы, получив электроны от своего электрода. Их места тут же занимают новые ионы, и через раствор начинает проходить электрический ток. Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чтобы получить много ионов, недостаточно растворить много вещества. Необходимо, чтобы взятая соль, кислота или основание хорошо распадались на ионы, то есть хорошо диссоциировали. Имеются такие химические соединения, которые диссоциируют очень хорошо, и почти все молекулы растворенного вещества распадаются на ионы. Но есть и такие, которые диссоциируют плохо: только очень незначительная часть всех растворенных молекул распадается на ионы, а остальные остаются в виде недиссоциированных молекул.
Отношение числа распавшихся молекул к общему числу растворенных молекул называется степенью диссоциации. Чем меньше степень диссоциации, тем хуже электропроводность раствора.
К соединениям, обладающим плохой электропроводностью, относится дистиллированная вода. Подсчитано, что из 10 миллионов молекул воды на ионы распадается только одна молекула, образуя один положительно заряженный ион водорода (Н+) и один отрицательно заряженный ион гидроксила (ОН—). Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
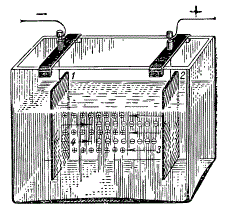
Прохождение электрического тока через раствор: 1 — катод; 2 — анод; 3 — положительно заряженные ионы — катионы; 4 — отрицательно заряженные ионы — анионы.
Нам уже известно, что кислота в воде диссоциирует на ионы водорода и кислотный остаток, а щелочь — на ионы металла и ионы гидроксила. Естественно было бы ожидать, что в растворе, подкисленном серной кислотой, на катоде будут разряжаться ионы водорода, а на аноде — ионы SO4—. Ионы водорода, разрядившись, перейдут в атомы, которые, соединяясь попарно, дадут молекулу водорода, а ионы SO4—, отдав свой заряд электроду, перейдут в раствор в виде незаряженного кислотного остатка — радикала SO4. Соединяясь с водой, этот радикал образует серную кислоту и кислород.
Можно было бы ожидать, что в щелочных растворах ионы натрия (Na + (e) → Na) разрядятся на катоде, переходя в атомы натрия, которые, соединяясь с водой, дадут щелочь и водород (2Na + 2H2O → 2NaOH + H2). На аноде ионы гидроксила, потеряв свои электроны, соединятся попарно, образуя из радикалов воду, освобождая кислород (4OH— — 4(e) → 2H2O + O2).
Однако в действительности в кислых и щелочных растворах процесс образования кислорода и водорода происходит иначе.
Несмотря на то, что в щелочных растворах имеется очень много ионов натрия и мало ионов водорода, на катоде в первую очередь разряжаются ионы водорода.
В растворах, подкисленных серной кислотой, на аноде прежде всего разряжаются ионы гидроксила, полученные за счет диссоциации воды, а не ионы SO4—, которых неизмеримо больше. Это объясняется тем, что разряд ионов водорода или гидроксила происходит легче, чем ионов натрия или SO4—. Поэтому в щелочных растворах, которые обычно применяются для электролиза воды, на катоде разряжаются главным образом ионы водорода, а на аноде — ионы гидроксила. Как только эти ионы разрядятся, немедленно образуются новые ионы за счет диссоциации молекул воды.
Таким образом, при электролитическом получении кислорода и водорода расходуется только вода. Литр воды дает примерно 1360 литров водорода и 680 литров кислорода.
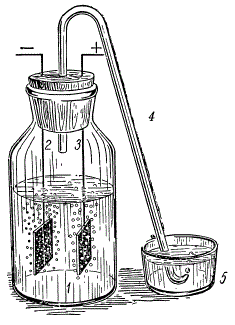
Электролиз воды: 1 — банка с электролитом; 2 — катод, на котором выделяется водород; 3 — анод, на котором выделяется кислород; 4 — трубка для отвода газов; 5 — чашечка с водой.
Под руководством учителя и соблюдая меры предосторожности, можно сделать опыт, показывающий, как разлагается вода.
Возьмите банку с широким горлом и наполните ее на две трети 20-процентным водным раствором щелочи. Плотно закройте банку пробкой, в которую вставлены две никелевые проволочки с небольшими пластинками на концах — электродами. В середину пробки вставьте коротким концом загнутую стеклянную трубку, через которую будут выходить газы. Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Вспомним свойство этой смеси газов. Если ее поджечь, она легко взрывается.
Поэтому подходить с огнем к банке опасно.
Чтобы убедиться, что в банке образовались кислород и водород, пропустите сначала немного газа через чашечку с чистой водой, а затем поставьте вместо нее чашечку с мыльной водой.
Образуются мыльные пузыри, наполненные гремучим газом. Раздастся легкий взрыв.
В пузыре была гремучая смесь — смесь одного объема кислорода с двумя объемами водорода.
Мы пока только разложили воду, но не разделили образовавшиеся газы и не получили кислорода.
