Под гомеостазом понимают постоянство химического состава и физико-химических свойств внутренней среды организма.
Проявлением гомеостаза является наличие ряда биологических констант, т. е. устойчивых количественных показателей, характеризующих нормальное состояние организма. К числу этих показателей относятся: температура тела, осмотическое давление жидкостей, концентрация водородных ионов, содержание белков и сахара, концентрация и соотношение биологически активных ионов и др.
Минеральные элементы, содержащиеся в виде растворимых солей в клеточной среде, интерстициальной жидкости, крови и лимфе, принимают прямое или косвенное участие в поддержании ряда перечисленных констант.
Поддержание ионного равновесия. Соли, растворимые в жидкостях, частично или полностью диссоциируют на электрически заряженные ионы — катионы и анионы.
Степень диссоциации растворимых электролитов зависит от pH среды.
Катионами при этом служат металлы (Na+, К+, Ca2+, Mg2+ и др.), анионами — ионы кислотного остатка (Cl—, HCO3—, SO42-, НРО42-, Н2РO4—). Катионом является также ион аммония — NH+, а анионами — органические кислоты и белок.
В норме все жидкости организма электронейтральны, так как суммы положительных ионов (катионов) и отрицательных (анионов) находятся в нем в эквивалентном соотношении.
Концентрацию электролитов в жидкостях организма принято выражать не по массе вещества в единице объема (мг%), а в миллиэквивалентах на литр (мэкв/л). Эта величина указывает на химическую эквивалентность изучаемого иона, т. е. на число радикалов противоположного знака, которые он может фиксировать.
Содержание электролитов в кормах и кале лучше выражать в грамм-эквивалентах (г-экв.).
Для простых ионов единица мэкв/л получается при делении величины концентрации мг/л на атомную массу и умножении на валентность.
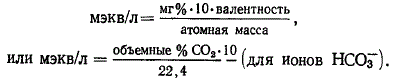
В случае комплексных ионов число миллиэквивалентов можно узнать, учитывая число диссоциированных валентностей.
Жидкие фазы организма (плазма, межклеточная жидкость, внутриклеточная жидкость) находятся в состоянии динамического равновесия. Однако наличие мембран между ними обеспечивает особенности электролитного состава жидкостей как в количественном, так и в качественном отношении.
Плазма крови — это раствор кристаллоидов, основным из которых является хлористый натрий, диссоциированный на ионы Na+ и Cl—. Около 90% натрия и 95% калия плазмы подвергается диализу; небольшие количества их связаны с белками и органическими кислотами. В основном хлор содержится в виде ионов, небольшая его часть связана, по-видимому, с сывороточным альбумином.
Несмотря на тесную связь между ионами Na+ и Cl— (парные ионы диссоциированного электролита), эквивалентных отношений между ними нет. Это объясняется явлением Доннана, согласно которому протеиновые ионы сосудистого русла «изгоняют» через капиллярную мембрану способные к диффузии ионы хлора.
Межклеточная (интерстициальная) жидкость находится в ионном равновесии с плазмой крови и практически является ультрафильтратом плазмы. В ней меньше белков и несколько выше концентрация Cl—-ионов.
По ионному составу внутриклеточная и внеклеточная жидкости значительно отличаются. Во внутриклеточной жидкости больше содержится катионов и анионов с вариациями в разных тканях (от 170 мэкв/кг в мышечной ткани до 203 мэкв/кг в мозговой). Однако в отличие от плазмы, где число активных ионов достигает 80%, в тканях их всего 35—45%. Внутриклеточная жидкость содержит мало ионов Na+, Cl—, НСО3—. В ней преобладают катионы К+, Mg2+, анионы НРО42- и полиэлектролиты (белки, нуклеиновые кислоты, фосфолипиды и т. д.). Одной из причин неравномерного распределения электролитов является неодинаковое взаимодействие ионов с коллоидными полиэлектролитами. А это зависит, в свою очередь, от величины гидратированных ионов. Важную роль в неравномерном распределении ионов по обе стороны плазматической мембраны играют также принудительные транспортные системы типа «насосов».
Для наглядности электролитный состав жидкостей организма изображается в виде ионограмм, предложенных Гемблом (Gemble, 1951). Слева приводятся данные о концентрации катионов, справа — о концентрации анионов.
У взрослых сельскохозяйственных животных ионограммы плазмы и межклеточной жидкости близки к таковым у других видов животных и поддерживаются стабильно в разных условиях кормления и содержания. Больше выражены возрастные различия, особенно у жвачных животных, что связано со сменой типов питания и соответствующими изменениями ионного состава кормов (уменьшением эквивалентной доли натрия, кальция, хлоридов и фосфатов и увеличением доли калия, магния и анионов органических кислот).
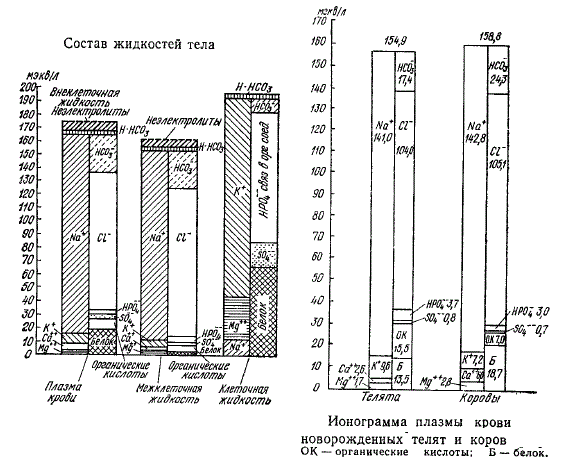
Общая ионная концентрация в крови у новорожденных жвачных находится на уровне взрослых животных, однако соотношение отдельных ионов иное. Что касается мочи, то здесь различия не только качественные, но и количественные. К 6-месячному возрасту, когда происходит становление функций пищеварения и наступает функциональная зрелость органов выделения, ионограммы крови и мочи уже аналогичны взрослым животным. Ионограммы слюны и молока взрослых коров следующие.

Ионы жидкостей организма обусловливают наряду с другими компонентами определенную величину осмотического давления, обеспечивают поддержание равновесия клеточных мембран, оказывают влияние на состояние коллоидов тканей (поддерживая необходимую степень их дисперсности), участвуют в регуляции кислотно-щелочного равновесия и наряду с этим выполняют другие специфические для каждого иона функции.
Поддержание осмотического давления. Растворенные соли создают в жидкостях организма определенное осмотическое давление, сохранение которого необходимо для нормальной жизнедеятельности.
Под осмотическим давлением понимают силу, обусловливающую движение растворителя через полунепроницаемую мембрану.
Ионизированные соли, диссоциирующие в растворе на ионы, повышают осмотическое давление в большей степени, чем неэлектролиты (мочевина, глюкоза) при той же молярной концентрации. Это обусловлено тем, что величина осмотического давления определяется суммарным количеством недиссоциированных молекул, коллоидных частиц и ионов.
Осмотическое давление в средах организма — важный физиологический фактор, способствующий перемещению в тканях воды и растворимых веществ. Если состав жидкостей тела вместо химических эквивалентов выразить в терминах осмоконцентрации, то получаются довольно сходные показатели, за исключением многовалентных ионов, имеющих низкий осмотический эффект.
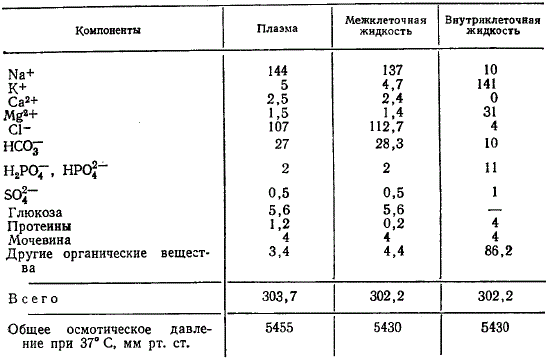
Осмотически активные вещества в жидкостях тела (миллиосмолей/л H2O)
Из таблицы видно, что вся осмоконцентрация внеклеточных жидкостей обеспечивается ионами натрия, хлора и бикарбоната, тогда как внутри клеток — главным образом калием, магнием и органическими веществами.
Действительный осмотический эффект жидкостей тела вследствие межмолекулярных и межионных сил притяжения составляет около 93% величины, теоретически вычисленной на основании их химического состава. В таблице 2 показатели осмотического давления скорректированы на эту величину. Осмотическая активность всех жидкостей тела примерно одинаковая, за исключением небольших различий между плазмой и межклеточной жидкостью. Эти различия обусловлены онкотическим давлением протеинов плазмы, которое хотя и невелико в сравнении с общим осмотическим давлением (примерно 1/200 часть), но играет важную роль в поддержании объема и давления крови.
Величина осмотического давления жидкостей организма определяется криоскопически, т. е. измерением температуры замерзания. Эта температура тем ниже, чем выше осмотическое давление.
Осмотическое давление крови, выраженное в атмосферах, равно 7—8 атм. В терминах, эквивалентных концентрации NaCl, кровь млекопитающих животных имеет осмотическое давление, равное 0,90%, птиц — 0,93—0,95, холоднокровных — 0,70%.
Осмотическое давление может быть изменено задержанием или удалением из организма необходимого количество воды, а также выведением осмотически активных веществ, главным образом NaCl, через почки и потовые железы.
Осмотическое давление мочи животных непостоянно и колеблется в больших пределах, что зависит от концентрации хлористого натрия. Однако в норме оно всегда выше, чем осмотическое давление крови. Это свидетельствует о выведении с мочой избытка солей. Осмотическое давление пота тоже непостоянно, но оно всегда ниже, чем в крови.
Избыток в корме животных поваренной соли повышает содержание NaCl в плазме, что приводит к увеличению ее осмотического давления. Плазма становится гипертоничной, что влечет за собой переход воды из интерстициальной жидкости в кровь и переход солей в обратном направлении.
В дальнейшем возрастает ионная концентрация во всем внеклеточном пространстве, вследствие чего вода выходит из клеток. В результате увеличиваются концентрация кристаллоидов и осмотическое давление во всех жидких фазах организма, уменьшается объем внутриклеточной жидкости. Несколько позже в реакцию вступают почки. Реабсорбция ионов Na+ (в обычных условиях почти абсолютная) уменьшается, выделение их с мочой возрастает; одновременно в моче повышается содержание мочевины и хлоридов.
При недостатке поваренной соли в рационе плазма крови животных становится гипотоничной. Вода начинает переходить из плазмы в интерстициальные пространства, а соли — в обратном направлении. Межклеточная, а затем и внутриклеточная жидкости становятся более разведенными; вода проникает в клетки без выхода из них солей. В итоге понижается осмотическое давление во всех жидких фазах организма, увеличивается объем внутриклеточной жидкости (тургор клеток), уменьшается объем внеклеточной. В почках наблюдается полная реабсорбция ионов Na+ и Cl—. Недостаток натрия нарушает почечную функцию: клубочковая фильтрация резко уменьшается, что сопровождается задержкой мочевины в крови.
При продолжительном солевом голодании регуляторные механизмы не обеспечивают поддержания гомеостаза, что приводит к гибели организма.
Поддержание кислотно-щелочного равновесия. Кровь и межклеточная жидкость имеют слабощелочную реакцию (pH 7,3—7,4). Во внутриклеточной жидкости концентрация водородных ионов выше (pH 7,0—7,2), что обусловлено интенсивным метаболизмом клеток.
Активная реакция клеточной и внутриклеточной жидкостей поддерживается на относительно постоянном уровне, несмотря на образование в процессе обмена кислых или щелочных продуктов. Иначе говоря, в организме поддерживается определенная степень кислотно-щелочного равновесия. Кислотно-щелочное равновесие следует рассматривать с позиции обмена Н+-ионов и тех компонентов внутренней среды, которые способны отдавать или принимать их. Кислотами считают вещества, которые могут служить донаторами Н+-ионов, а основаниями — вещества, способные присоединять и связывать Н+-ионы.
Освобождению Н+-ионов, с одной стороны, способствует образование в процессе метаболизма неорганических (H2SO4) [в среднем 60 мэкв на каждые 100 г расщепленного протеина] и органических кислот (фосфопировиноградной, молочной, уксусной, ацетоуксусной, оксимасляной, α-кетокислот). При соединении этих кислот с буферными основаниями запасы последних могут снижаться, что влечет за собой освобождение из организма эквивалентного количества Н+-ионов. Донаторами Н+-ионов при этом могут служить угольная кислота (H+·HCO3—), ионы вторичного фосфата (H+·HPO4—), ионы аммония (H+·NH3—).
H2CO3 образуется в организме в наибольшем количестве (50:1 по отношению к другим кислотам в эквивалентном выражении).
С другой стороны, причиной освобождения Н+-ионов для поддержания кислотно-щелочного равновесия может служить интенсивное образование в организме аммиака, поступление большого количества калиевых солей органических кислот. Метаболизм органического остатка этих солей включает присоединение Н+-ионов, вследствие чего их концентрация в организме снижается. В результате освобождаются Н+-ионы из угольной кислоты (H+·HCO3—); избыточный ион К+ нейтрализуется бикарбонатом и выводится с мочой.
В борьбе с нарушениями кислотно-щелочного равновесия организм использует три основных механизма: химические буферы, легочный механизм регуляции угольной кислоты в крови, экскрецию Н+-ионов или HCO3—-ионов с мочой.
Буферные системы организма (белковая, карбонатная и фосфатная) способны обратимо связывать ионы водорода и тем самым противодействовать изменению pH среды. В крови и межклеточной жидкости буферная способность обеспечена главным образом гемоглобином и в меньшей степени бикарбонатной и фосфатной буферными системами; в тканях основными буферами являются белки и фосфаты.
Главным белковым буфером крови является калиевая соль оксигемоглобина — КНbO2, содержащаяся в эритроцитах. В капиллярной системе тканей кислород освобождается из КНbO2, восстановленный гемоглобин соединяется с угольной кислотой и образуется бикарбонат калия. При этом ион бикарбоната частично выходит в плазму, а ион водорода связывается гемоглобином:
KHbO2 → O2 (→ткани) + KHb + H2CO3 → HHb + KHCO3
В легких HHb присоединяет кислород, образуя HHbO2 со свойствами сильной кислоты. Последний вытесняет из бикарбонатов (диффундирующих из плазмы в эритроциты) ион К+, снова превращаясь в калиевую соль оксигемоглобина:
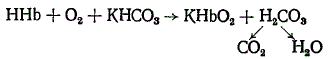
Переход ионов бикарбоната из эритроцитов в плазму и обратно уравновешивается диффузией в обратном направлении ионов хлорида (Cl—). Благодаря описанным превращениям гемоглобин обеспечивает более 70% всей буферной способности крови.
Фосфатная буферная система представлена двузамещенным фосфатом натрия — Na2HPO4, который диссоциирует с образованием двух ионов натрия (Na+) и иона вторичного фосфата (НРО42-).
Ионы вторичного фосфата связывают протоны и дают первичные фосфатные ионы, которые, в свою очередь, могут диссоциировать на ион водорода и анион.
НРО42-·НРО42- + H+ ↔ H2PO4—
Таким образом, вторичные фосфатные ионы подобны слабой щелочи, а первичные фосфатные ионы — слабой кислоте. Аналогичным образом связываются фосфатами и ОН—-ионы:
Н2РО4— + OH— → НРО42- + H2O
Буферная емкость фосфатных ионов в тканях и крови невелика, однако первичные и вторичные фосфаты являются главным буфером мочи. При избытке в организме кислот с мочой выделяются в основном первичные фосфаты, при избытке оснований — вторичные и даже третичные. Соответственно меняется и pH мочи.
У жвачных щелочность мочи обеспечивается в основном бикарбонатами.
Карбонатная буферная система представлена бикарбонатом натрия, диссоциирующим на ионы натрия и бикарбоната:
NaHCO3 → Na+ + HCO3—.
Ион HCO3— связывает ион водорода согласно уравнению:
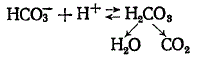
Свободная угольная кислота неустойчива и распадается (в тканях под влиянием карбоангидразы) на углекислый газ и воду, избыток которых выводится соответственно через легкие и почки.
Бикарбонатный буфер предохраняет организм животных от сдвига реакции в кислую сторону при образовании органических кислот, например молочной:
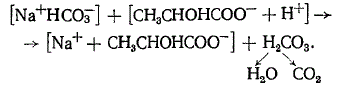
Свободная угольная кислота способна связывать ОН—-ионы с образованием ионов бикарбоната:
Н2CO3 + ОН— ↔ H2O + HCO3—
Организм особенно хорошо защищен от сдвига реакции в кислую сторону, и важная роль в этом принадлежит карбонатной системе, которая обеспечивает до 20% буферной емкости всей крови и большую часть буферной емкости плазмы.
Запас бикарбонатов плазмы, способных нейтрализовать поступающие в кровь кислые продукты, объединяют общим названием щелочного резерва крови. Этот запас достаточно велик, чтобы нейтрализовать всю массу кислых продуктов, внезапно перегружающих кровь, например при интенсивной мышечной деятельности. Величина щелочного резерва неодинакова у разных видов животных; у молодняка она ниже, чем у взрослых животных.
Поскольку состояние кислотно-щелочного равновесия в крови и тканях может зависеть от характера питания животных, а нарушения этого равновесия приводят к снижению продуктивности и ухудшению воспроизводства, в зоотехнической практике кислотнощелочное соотношение учитывают при составлении рационов. При этом предполагается, что элементами-донаторами кислот являются содержащиеся в кормах фосфор, хлор, сера, а кальций, магний, натрий и калий дают щелочные остатки.
Современные знания об обмене веществ и кислотно-щелочном балансе позволяют внести в это представление существенные коррективы.
1. Понятие об избытке в нативных кормах анионов или катионов само по себе лишено смысла. Растительные и животные корма являются производными живых организмов, в средах которых суммы анионов и катионов находятся в эквивалентном отношении. При оценке «кислотности» или «щелочности» кормов часто не учитывают в качестве анионов бикарбонаты, белок и органические кислоты.
2. Более применимо понятие «кислотность» или «щелочность» к золе корма, полученной после его сжигания. Наличие аналогичных механизмов «сжигания» предполагается и в организме (органические кислотные остатки сгорают, а катионы остаются). Однако эта весьма отдаленная аналогия не отражает превращений минеральных веществ в желудочно-кишечном тракте и в процессе межуточного метаболизма.
3. Представление о том, что анионы всегда образуют в организме кислотные остатки, а катионы — щелочные, ошибочно. Так, ион вторичного фосфата HPO42- служит акцептором протонов, а ион первичного фосфата H2PO4— — его донатором, т. е. первый выполняет функцию щелочного буфера, а второй — кислотного. То же самое можно сказать об аммиаке и ионе аммония. Иначе говоря, можно говорить о молекулах, анионах и катионах как кислот, так и оснований.
4. Равенство катионов и анионов, определяющее электронейтральность жидкостей организма, вовсе не означает равновесия кислых и щелочных эквивалентов. При суммарном равенстве ионов может происходить сдвиг реакции среды как в кислую, так и в щелочную сторону.
5. Совершенно очевидно, что некоторые сильные катионы и анионы не оказывают непосредственного влияния на кислотно-щелочное равновесие. Так, ионы Na+ и К+ сами по себе не изменяют концентрации Н+-ионов, так как не являются ни кислотами, ни щелочами. Однако эти катионы необходимы для других важных процессов, регулирующих кислотно-щелочное равновесие, и замена их на ионы Н+ или наоборот имеет большое физиологическое значение.
Сильный катион аммония исключителен в том отношении, что может служить донатором протонов и, следовательно, может быть отнесен к слабым кислотам. Анионы хлорида и сульфата почти не оказывают влияния на концентрацию Н+-ионов, поскольку они являются чрезвычайно слабыми основаниями.
6. Кислотность или щелочность корма определяется, следовательно, не столько содержанием в его золе кислых или щелочных элементов, сколько природой продуктов, которые поступают в организм или образуются в нем в процессе метаболизма.
Показателем щелочного или кислого характера кислотно-щелочного равновесия является реакция мочи. Так, у молодняка жвачных моча имеет кислую реакцию, а у взрослых — щелочную. Это определяется не преобладанием в моче кислых или щелочных эквивалентов, а характером выделяемых с мочой катионов и анионов.
Принимая во внимание изложенное, можно считать, что организм сельскохозяйственных животных обладает достаточными регуляторными механизмами, препятствующими возникновению патологических сдвигов pH при обычных условиях кормления. Эти механизмы имеют видовые особенности, т. е. приспособлены к характеру питания данного вида животных.
Приведенные данные заставляют также пересмотреть некоторые общепринятые представления о кислом и щелочном характере кормов и реализации этой потенциальной «кислотности» или «щелочности» в организме.
С точки зрения патологии более опасно для организма эндогенное нарушение кислотно-щелочного равновесия, т. е. избыточное образование кислых или щелочных продуктов в нем самом.
Метаболический ацидоз может быть связан, в частности, с повышенным образованием нелетучих кислот, которые, вступая в реакцию с буферными основаниями, извлекают из крови бикарбонатные ионы. Метаболические расстройства подобного рода известны как кетозы, возникающие вследствие нарушения углеводножирового обмена и сопровождающиеся повышенным образованием недоокисленных продуктов.
Компенсаторные реакции, включающие усиленное выделение CO2 легкими и экскрецию Н+-ионов почками, не всегда оказываются достаточными, вследствие чего возникает декомпенсированный ацидоз. Продолжительные и сильные диареи, приводящие к потере бикарбонатных ионов (обычно абсорбируемых в кишечнике), также могут быть причиной метаболического ацидоза.
Выдвинута гипотеза об образовании бикарбонатов в стенке рубца (CO2 + H2O → Н2СO3 → H+·HCO3—)
