Мышечная ткань является наиболее важной составной частью мяса по питательным и вкусовым достоинствам. Мускулатуру туши животного можно разделить на две группы: поперечнополосатую, или скелетную, мускулатуру, совершающую все произвольные движения, и гладкую — мышцы желудка, кишечника, пищевода, совершающие ритмичные непроизвольные движения. С точки зрения пищевой ценности большее значение имеет поперечнополосатая мышечная ткань.
Основным структурным элементом мышечной ткани является мышечное волокно. Волокна — это длинные, многоядерные клетки. Диаметр мышечных волокон зависит от типа мышц, вида, породы, пола животных и колеблется в пределах от 10 до 100 мкм, увеличивается с возрастом животного, на него влияют характер кормления и тренированность животных. Установлена корреляция между диаметром мышечного волокна и некоторыми характеристиками качества — консистенцией и нежностью.
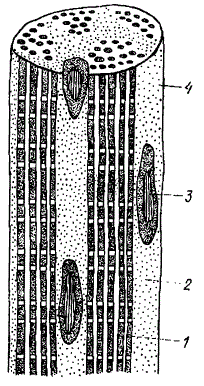
Схема строения мышечного волокна: 1 — миофибрилла; 2 — саркоплазма; 3 — ядро; 4 — сарколемма
Мышечное волокно окружено двухслойной оболочкой — сарколеммой. Электронно-микроскопическими исследованиями установлено, что сарколемма представляет собой двойную мембрану, компоненты которой расположены на расстоянии около 50—60∙10-10 м. Между эндомизием и сарколеммой может находиться спиральная коллагеновая структура. Многочисленные ядра находятся на периферии клетки под оболочкой. Внутри мышечного волокна по его длине расположены длинные нитеподобные волокна — миофибриллы, занимающие около 60—65% внутреннего объема волокна. Они являются сократительными элементами мышечного волокна.
При просмотре миофибрилл под микроскопом обнаруживают темные и светлые участки, расположенные поперек волокна. При исследовании в поляризационном микроскопе темные участки миофибрилл обнаруживают двойное лучепреломление (анизотропны), а светлые не обладают этим свойством (изотропны). Такая оптическая неоднородность этих участков обусловлена различиями в их строении и белковом составе. Миофибриллы расположены в мышечном волокне таким образом, что их темные и светлые участки совпадают и образуют сплошные чередующиеся поперечные светлые и темные полосы.
Внутри клетки, кроме ядер и миофибрилл, имеются и другие органеллы: митохондрии, рибосомы, лизосомы и др. Все эти структурные образования окружены саркоплазмой, полужидкой частью клетки, занимающей 35—40% ее внутреннего объема.
Мышечные волокна разделены тончайшими прослойками соединительной ткани — эндомизием, который связан с внешней мембраной сарколеммы. Группа мышечных волокон образует первичный мышечный пучок, окруженный соединительнотканной оболочкой — внутренним перимизием. Размер пучков определяется числом волокон и их диаметром. Первичные пучки объединяются в пучки вторичные, третичные, которые соответственно окружены соединительнотканными оболочками, называемыми перимизием, и в совокупности образуют мышцу (мускул). Мышца также окружена оболочкой — эпимизием, или фасцией. Мышцы можно отделить друг от друга по фасциям и использовать в соответствии с пищевой ценностью.
Для консистенции мяса важное значение имеет содержание соединительнотканных образований — эндомизия, перимизия, эпимизия и фасции, которые построены из коллагеновых волокон и содержат небольшое количество эластиновых и ретикулиновых волокон. В перимизии и эпимизии мышц откормленных животных находятся жировые клетки, образующие «мраморность» на поперечном разрезе мяса.
Установлена корреляция между диаметром мышечного волокна и некоторыми характеристиками качества баранины. Диаметр мышечного волокна увеличивается по мере увеличения массы туш. Однако диаметр волокон длинной поясничной мышцы растет сравнительно меньше, чем масса этой мышцы и туши.
Мясо отличается наиболее благоприятным соотношением важнейших питательных веществ, которое должно максимально сохраняться при дальнейшей переработке в целях получения продукта высокого качества. Значение мяса как белкового продукта определяется прежде всего содержанием белка и хорошо сбалансированным составом аминокислот. Оптимальный состав незаменимых аминокислот у яичного белка. После яйца и молока мясо относится к продуктам, обладающим наиболее благоприятным соотношением этих биологически ценных веществ. Пищевая ценность мышечной ткани, как и мяса в целом, определяется главным образом питательной и биологической ценностью содержащихся в ней белковых веществ.
Углеводы и жиры являются для организма главным источником энергии и в незначительном количестве входят в состав некоторых структурных элементов. Функции белков значительно более разнообразны.
Мясные продукты являются прежде всего источником белковых веществ, необходимых организму. Белки являются основным строительным материалом для клеток и тканей организма в процессах синтеза белков, ферментов, гормонов. Ткани организма животных и человека постоянно обновляются. Половина имеющегося в теле взрослого человека белка обновляется в течение 80 сут. Регенерация белковых структур тела может осуществляться только за счет белков пищевых продуктов. Белки являются исходным материалом для построения ферментов и многих гормонов, служат источником энергии, хотя в меньшей степени, чем углеводы и жиры.
Белковые вещества участвуют в осуществлении основных проявлений жизни: обмене веществ, сокращении мышц, процессах роста, размножения и в высшей форме движения материи — мышлении. В желудочно-кишечном тракте белки, расщепляются до аминокислот, которые всасываются в кровь и разносятся по всему организму. Из аминокислот организм строит специфические белки с определенным расположением и последовательностью аминокислот.
Исключение жиров и углеводов из рациона питания на довольно продолжительное время возможно. При этом не наблюдается нарушение функциональной деятельности организма. Исключение белков из пищевого рациона лишь на непродолжительное время (несколько дней) обусловливает глубокие нарушения обмена веществ. Недостающее количество белков в рационе питания приводит к задержке или полному прекращению роста и значительным расстройствам функциональной деятельности всего организма.
Белки отличаются друг от друга количеством и качеством входящих в их состав аминокислот. В зависимости от состава аминокислот белки подразделяют на полноценные и неполноценные. Большинство аминокислот, из которых образованы белки нашего организма и которые необходимы для построения этих веществ, могут синтезироваться самим организмом. Поскольку организм взрослого человека не может синтезировать 8 из 20 аминокислот, составляющих белки, они должны поступать в организм с пищей. Такие аминокислоты относят к незаменимым. К ним относятся: валин, лизин, лейцин, изолейцин, метионин, триптофан, треонин, фенилаланин. Для растущего детского организма незаменимой аминокислотой является также гистидин.
Белковые вещества, не содержащие хотя бы одну незаменимую аминокислоту или содержащие ее в незначительном количестве, относятся к числу неполноценных. Аминокислоты, входящие в состав неполноценных белков, также используются организмом в процессе синтеза некоторых белков и гормонов, для которых отсутствует необходимость наличия полного набора радикалов незаменимых аминокислот (для коллагена — триптофан, для эластина — триптофан и метионин). Из этого следует целесообразность введения неполноценных белков в состав продуктов.
Биологическая ценность белка определяется не только наличием аминокислот в его составе, но и их количественным соотношением. Любое отступление в сторону увеличения или уменьшения содержания отдельной аминокислоты нарушает использование всей смеси аминокислот. Установлено, что наиболее высокой биологической ценностью обладает и в наибольшей степени усваивается организмом белок, по аминокислотному составу и свойствам наиболее близкий к составу белков в организме человека. Важное значение животных белков обусловлено не только соответствующим количественным содержанием аминокислот, но и присутствием в них характерных форм связей между некоторыми аминокислотами, трудно синтезируемых или несинтезируемых в организме.
Цистин не является незаменимой аминокислотой, однако может заменить до 80—90% минимальной потребности растущего организма в метионине. В обмене веществ при отсутствии цистина для его образования используется часть метионина. О значении метионина и цистина в мясе можно судить по данным К. Ланд. Усвоение незаменимых аминокислот, принимающих участие в синтезе белка в организме, ограничивается недостаточным содержанием в мясе метионина, цистина и фенилаланина.
Когда белок является единственным компонентом диеты или, когда он является частью диеты, его пищевая ценность зависит от того, удовлетворяет ли его аминокислотный состав потребности в нем человека. Следовательно, пищевая ценность мясного белка связана с составом других белков, с которыми его используют.
Рассчитано, что для человека оптимальное соотношение незаменимых аминокислот в пище должно быть следующим (в частях):
- Триптофан 1
- Треонин 2—2,7
- Метионин 2,2—3,5
- Фенилаланин 2—4
- Изолейцин 2,9—4
- Валин 3,2—4,2
- Лизин 3,2—4,6
- Лейцин 4,7
- Гистидин 1,5 (для детей)
При недостаточном количестве какой-либо из названных аминокислот в рационе питания, другие аминокислоты полностью не используются организмом для синтеза белковых веществ. Следовательно, если соотношение незаменимых аминокислот в составе белкового рациона отличается от оптимального, то потребность в них для синтеза белков нашего организма определяется минимальным содержанием одной или нескольких незаменимых аминокислот. Биологическую ценность белковой пищи можно повысить введением в ее состав недостающего количества незаменимых аминокислот за счет подходящих белков, в том числе и неполноценных. Однако добавление недостающей аминокислоты не превращает автоматически несбалансированный белок в белок высокого качества (полноценный белок).
Соотношение аминокислот зависит от вида мышц, породы и возраста животного и может отличаться в зависимости от расположения мышц в туше, т. е. от физиологической функции данной мышцы при жизни животного. Содержание аргинина, валина, метионина, изолейцина и фенилаланина возрастает с увеличением возраста животного. Снижение содержания лизина в говядине наблюдается при тепловой обработке и копчении. Аминокислоты могут исчезнуть и при длительном хранении консервированного мяса. При хранении сублимированного мяса при 20° С в течение одного года потери лизина составили 50%.
Мясо богато аминокислотами — триптофаном, лизином и метионином. Белки мяса хорошо усваиваются организмом, повышают степень усвоения растительных белков и дают возможность сбалансировать аминокислотный состав пищи.
Оценку пищевых продуктов рекомендуется проводить по содержанию трех наиболее дефицитных, часто лимитирующих биологическую ценность аминокислот: триптофана, лизина, метионина. Установлено, что заменимые аминокислоты существенно влияют на потребность в незаменимых аминокислотах. В мясе свинины и говядины 85% белковых веществ мышечной ткани относятся к полноценным, в мясе птицы — 93%. Белки мышечной ткани в основном легче расщепляются пищеварительными ферментами (пепсином, трипсином, химотрипсином), чем растительные белки, поэтому они усваиваются организмом в большей степени, чем растительные.
Белки мышечной ткани сосредоточены в основном в мышечном волокне, белковый состав которого можно представить в виде схемы.
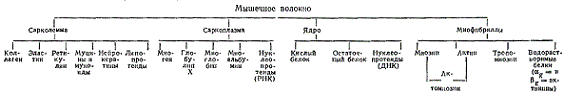
В сарколемме мышечного волокна содержатся неполноценные белки: коллаген, эластин, ретикулин. Количество этих белков примерно 2,5% от общего содержания белков в волокне. В составе мембран сарколеммы, помимо белков, имеются фосфолипиды, сфингомиелины и инозитолфосфатиды. В межволоконном пространстве встречаются муцины и мукоиды, слизеподобные белки, выполняющие защитные функции и облегчающие скольжение мышечных пучков. На поверхности сарколеммы и в межмышечных промежутках находятся нервные волокна и нервный аппарат клеток, в состав которых входят липопротеиды и нейрокератины.
В состав ядра мышечного волокна входят сложные белки пуклеопротеиды (около 50% сухого вещества ядер) — соединения белка и дезоксирибонуклеиновых кислот (ДНК), а также малоизученные кислый и остаточный белки. Белковыми компонентами нуклеопротеидов являются гистоны, в которых отсутствует триптофан. Общее содержание нуклеопротеидов в мышцах 0,2—0,25%. Кислый белок по свойствам напоминает глобулины и содержит в своем составе триптофан. Остаточный белок по своим свойствам и аминокислотному составу похож на коллаген.
Белки саркоплазмы характеризуются обычно глобулярным строением молекул. Это полноценные, в основном водорастворимые, белки, которые составляют от общего количества белковых веществ мышечного волокна следующий процент: миоген — 20%, глобулин X — 20, миоальбумин — 1—2, миоглобин — 1%. Все они, за исключением миоглобина, гетерогенны, т. е. состоят из нескольких фракций белков, близких по физико-химическим и биологическим свойствам.
Фракция миогена растворима в воде, имеет pH 6,0—6,57; температура свертывания 55—66° С. В составе этой фракции содержатся многие ферменты мышечной ткани. Один из белков фракции миогена обладает альдолазной активностью, т. е. способен расщеплять 1,6-фруктозодифосфат на две фосфотриозы. Глобулин X является псевдоглобулином, так как для его растворения достаточно того количества солей, которое имеется в мышечной ткани (1—1,4%). Изоэлектрическая точка глобулина X находится при pH 5,2. В растворе белок коагулирует при 50° С. Миоальбумин является типичным альбумином. Его изоэлектрическая точка при pH 3,0—3,5; температура коагуляции 45—47° С.
Миоглобин состоит из белковой части — глобина и небелковой части — гема, в составе которого содержится железо. Он окрашен в темно-красный цвет и обусловливает естественную окраску мышечной ткани. Мышцы, выполняющие при жизни животного большую физическую работу, содержат значительно больше миоглобина (Mb), чем мало работающие мышцы. При жизни животного Mb участвует в питании мышц кислородом, получая его от гемоглобина (Hb) крови. Это объясняет различие окраски отдельных мышц. Мясо молодых животных окрашено менее интенсивно, чем мясо старых животных, в мускулатуре которых содержится больше Mb и Hb. Характерной чертой Mb является его способность легко соединяться с различными газами — кислородом, окисью азота, сероводородом, углекислым газом, аммиаком. При этом железо гема не окисляется (остается двухвалентным). Соединение Mb с кислородом — оксимиоглобин (MbO2), имеющее ярко-красную окраску, легко диссоциирует на Mb и кислород, а соединение Mb с NO, H2S и другими газами более стойко. При длительном воздействии кислорода воздуха и некоторых других реагентов железо гема окисляется в трехвалентное и Mb превращается в метмиоглобин (МетMb), окрашенный в коричневый цвет. МетMb при некоторых условиях может быть вновь восстановлен в Mb.
После убоя животного в поверхностном слое мяса толщиной до 2—3 см Mb, присоединяя кислород, переходит в светло-красный MbO2, в то время как более глубокие слои мышечной ткани содержат Mb и они более темные. При длительном хранении мяса в поверхностных слоях MbO2 окисляется и переходит в МетMb. При этом мясо приобретает на поверхности коричневый, а позже и темно-коричневый цвет. Глубинные слои сохраняют естественный пурпурно-красный цвет.
Миофибриллярные белки — миозин и актин — являются полноценными белками и составляют основную часть белковых веществ мышечного волокна: миозин — 40% и актин — 15%.
Миозин обладает высокой способностью к гидратации. Это обусловлено относительно большим количеством полярных аминокислотных боковых цепей, а также фибриллярной формой молекулы. Миозин и актин обладают способностью связывать ионы кальция, магния и калия. Заряд белка зависит от количества связанных ионов, главным образом калия. Миозин взаимодействует с другими белками и компонентами клетки, например образует прочные комплексы с гликогеном, липидами.
Молекула миозина включает 5000 аминокислотных остатков, принадлежащих 20 аминокислотам. Изоэлектрическая точка миозина находится при pH 5,4, а температура свертывания 45—50° С. Молекулярная масса миозина окончательно не установлена из-за сложности строения его молекулы и способности молекул ассоциировать друг с другом. Она находится в пределах 500 000. Миозин представляет собой комплекс двух близких по свойствам белков — H-меромиозина, или тяжелого миозина, и L-меромиозина, или легкого миозина. Тяжелый миозин обладает свойствами фермента аденозинтрифосфатазы. Предполагается, что способность миозина соединяться с АТФ и его АТФ-азная активность зависят от наличия в его молекуле SH-группы. Он гидролитически расщепляет АТФ на аденозиндифосфорную кислоту (АДФ) и фосфорную кислоту:
АТФ + Н2О → АДФ + Н3РO4 + энергия (33,5 кДж/моль).
Выделяющаяся энергия используется в процессах мышечного сокращения. Тяжелый миозин обладает способностью связываться с актином.
Актин содержится в мышечном волокне в двух формах: глобулярной — Г-актин (молекулы шаровидные) с молекулярной массой 47 000 и фибриллярной — Ф-актин (молекулы вытянутые) с молекулярной массой 1 500 000. Обе формы могут переходить друг в друга, причем Ф-актин является полимеризованным, нитевидным производным Г-актина с двухспиральной структурой. Каждая спираль состоит из 200—300 глобул Г-актина. Этот переход осуществляется под влиянием критических концентраций ионов калия и магния и при участии сульфгидрильных групп белка.
Актомиозин — сложный комплекс, состоящий из двух белков — актина и миозина. Диссоциация актомиозина на актин и миозин происходит под действием АТФ, а также при высокой концентрации солей (например, KCl 2-молярной концентрации).
В мышечной ткани миозин может находиться или в комплексе с актином, или в диссоциированном состоянии в зависимости от физиологического состояния мышцы. Соотношение актина, миозина и актомиозина взаимосвязано и взаимообусловлено; оно зависит от многих факторов.
Строение миофибрилл изучено глубоко электронно-микроскопическими исследованиями. Изучением продольного и поперечного срезов миофибрилл выявлено наличие многочисленных нитей —протофибрилл, являющихся основными структурными элементами миофибрилл. Обнаружено два типа протофибрилл — тонкие и толстые. Тонкие состоят из актина и имеют диаметр около 50∙10-10 м, а толстые состоят в основном из миозина и имеют диаметр около 10-12 м. Тонкие протофибриллы прикреплены к так называемым полоскам Z и вклиниваются между толстыми так, что вокруг каждой из толстых располагается 6 тонких. Толстые и тонкие протофибриллы соединены друг с другом поперечными мостиками. В мышечных волокнах в состоянии покоя нити миозина и актина вклиниваются одни между другими не на всю длину, а только частично. При распаде АТФ активизируются их функциональные группы, в результате чего группы актина передвигаются по поверхности миозиновых нитей. Образуется новый белковый комплекс — актомиозин, что сопровождается укорачиванием миофибрилл.
Тропомиозин содержится в количестве 2,5% от содержания белка в волокне; он является неполноценным белком (отсутствует триптофан). Изоэлектрическая точка тропомиозина при pH 5,1. Его характерной особенностью является устойчивость к денатурации. Остальные белки миофибрилл недостаточно изучены.
Жиры и липоиды составляют 3% веществ мышечного волокна. Они выполняют функции двоякого рода. Часть их, главным образом фосфолипиды, является пластичным материалом и входят в структурные элементы мышечного волокна — миофибриллы, клеточные мембраны, прослойки гранул, митохондрии. Фосфолипиды способствуют проявлению активности ряда ферментов. Другая часть липидов, в основном триглицериды, выполняет роль резервного энергетического материала и содержится главным образом в межклеточных соединительнотканных образованиях, между пучками мышц (в перимизии) и между отдельными мускулами (в эпизимии). Суммарное содержание триглицеридов в мышцах животных резко варьирует, при усиленной их работе сокращается до минимума. Общее содержание липидов в мышечной ткани зависит от вида животного, возраста, пола, упитанности.
Для характеристики пищевой ценности мяса наряду с основным составом требуются все более полные данные о содержании веществ, встречающихся в небольших количествах, но играющих важную роль в питании и обмене веществ в организме. В составе мышечной ткани содержатся экстрактивные вещества, извлекающиеся горячей водой (80°С). В процессах автолиза экстрактивные вещества подвергаются химическим изменениям с образованием веществ, влияющих на органолептические свойства мяса. Экстрактивные вещества содержатся в мышечной ткани в небольшом количестве, однако они играют важную роль, так как среди них находятся вкусовые, ароматические и биологически активные вещества (витамины, вещества с гормональными свойствами). Общее содержание экстрактивных веществ в мышцах 1,7%. К азотистым экстрактивным веществам относятся креатин, креатин — фосфат, фосфаген, АТФ, АДФ, АМФ, холин, свободные аминокислоты, органические основания, мочевина, аммиак, аммонийные соли.
Содержание азотистых экстрактивных веществ в мышцах охлажденного мяса представлено ниже (в % на сырую ткань):
- Кариозин: 0,2—0,3
- Ансерин: 0,09—0,15
- Кариотин: 0,02—0,05
- Холин: 0,08
- Креатин + креатинфосфат: 0,2—0,55
- АТФ: 0,25—0,4
- Инозиновая кислота: 0,01
- Пуриновые основания: 0,07—0,23
- Свободные аминокислоты: 0,1—0,7
- Мочевина: 0,002—0,2
Кариозин и ансерин действуют стимулирующе на секрецию пищеварительных желез. Свободный холин вызывает перистальтику кишечника. По своей роли в питании он отнесен к витаминам. Среди азотистых экстрактивных веществ мышечной ткани определенный интерес представляют небелковые и нелипидные фосфаты. Наиболее важными из них являются АТФ и другие нуклеозидтрифосфаты, которые содержат богатые энергией фосфатные связи (макроэргические связи). Макроэргическую связь имеют и другие соединения, и в частности дифосфорилированные нуклеотиды (АДФ и др.) и креатинфосфат (фосфаген). Много креатинфосфата содержится в интенсивно работающих мышцах, так как это соединение выполняет роль легко мобилизуемого резерва энергии при мышечном сокращении. Небелковые и нелипидные органические фосфатные соединения очень хорошо растворяются в воде. Их содержание в свежей мышечной ткани составляет 0,3—0,5% (на сырую ткань).
После убоя животного в мышечной ткани под воздействием ферментов органические фосфаты распадаются, уменьшается содержание фосфора, органических фосфатов и увеличивается количество более простых азотистых продуктов и неорганического фосфата.
К безазотистым экстрактивным веществам относятся гликоген и продукты его превращения: декстрины, мальтоза, глюкоза, инозит и их фосфорные эфиры, а также молочная, янтарная, пировиноградная кислоты и другие вещества. Гликоген является сильно разветвленным полисахаридом, построенным из молекул α-глюкозы, и представляет собой энергетический запасный материал для работы мышц. Он откладывается главным образом в печени (до 18%) и в мышечной ткани (до 0,8%). Молекулярная масса гликогена снижается во время работы мышц, при голодании, недостатке кислорода и увеличивается при отдыхе. Гликоген мышечного волокна может связываться с белками (миозином, миогеном) или же находится в свободном состоянии, он локализован у анизотропных дисков, равномерно распределен в саркоплазме.
Источник: Ю.Ф. Заяс. Качество мяса и мясопродуктов. Легкая и пищевая промышленность. Москва. 1981
