Манчестерская лаборатория Резерфорда бурлила спорами. Новая теория строения атома была гвоздем всех разговоров. Каждый вечер после работы молодые сотрудники лаборатории собирались за чаем. На лабораторном столе расставляли чашки, раскладывали пирожки и бутерброды. Резерфорд, взгромоздившись на высокий табурет, дирижировал диспутами.
Бор постоянно размышлял над тем, как бы приложить структуру атома, открытую шефом, структуру, в которой он совершенно не сомневался, к объяснению свойств элементов… Ведь не исключено, что все химические свойства элементов определяются всего-навсего электронами, которые крутятся вокруг атомного ядра…
Он также предполагал, что источниками альфа- и бета-лучей являются ядра атомов.
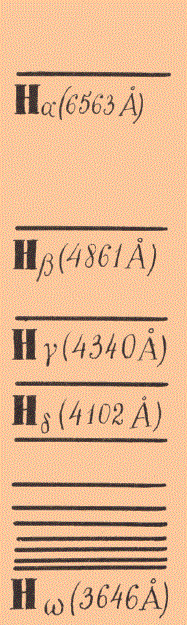
Бальмеровская серия водорода
Но для того чтобы эти предположения перешли в ранг теории, их следовало доказать. Между тем классическая электродинамика совершенно безапелляционно заявляла, что заряженная частица (читай: электрон), вращающаяся вокруг другой, более массивной частицы, заряженной электричеством другого знака (читай: ядро), должна с каждым витком притягиваться этой массивной частицей, терять (читай: излучать) при этом излишки своей энергии. И в конце концов падать на центральную массу! Как же быть?..
Но Бор недаром внимательно изучал квантовую теорию Планка и Эйнштейна. И поскольку атомы имели совершенно иную категорию, чем макроскопические тела, то неоднократно крамольная мысль посещала его голову: а можно ли вообще пользоваться законами классической электродинамики, выведенными для макротел, при объяснении структуры атомов?..
И он выдвигает предположение, что вокруг ядра для электронов существует ряд «разрешенных» орбит, по которым электроны могут вращаться, не излучая энергии, то есть устойчиво и постоянно. Такие «разрешенные» орбиты собирались в стабильную оболочку. И по ним, согласно расчетам Бора, могло вращаться не более семи электронов. Тогда система атома устойчива. Появится восьмой электрон — наступит неустойчивость, и атом данного элемента должен превратиться в атом другого элемента уже не с одной, а с двумя стабильными оболочками. Причем вторая, начавшаяся с восьмого по счету электрона, может также заполняться семью следующими… «Рассматриваемая модель атома может дать вероятное объяснение периодического закона химических свойств элементов». Этими словами Бор закончил свою первую статью, рукопись которой прочитал Резерфорду.
Руководитель, как и полагалось, предостерег своего подопечного от скоропалительных выводов, но потом не выдержал тона наставника и с жаром принялся обсуждать предложенные идеи. Разговор закончился тем, что Резерфорд предложил Бору готовить статью к публикации.
Надо ли говорить о том, как счастлив был молодой ученый…
Но ввести новую теорию строения атома было не так-то просто. Слишком много связей оказывалось у «кирпичика вещества» и с разными отраслями наук.
Однажды ассистент физической лаборатории Политехнического института в Копенгагене, молодой физик X. М. Хансен, специализировавшийся в Геттингене в области спектроскопии, спросил у Бора:
— А каким образом ваша модель атома может объяснить спектральные линии, которые испускает возбужденный атом?
Это был коварный вопрос. Бор ответил просто: «Не знаю!» Но в глубине души понял, что отвечать ему придется. А проблема была сложной и имела длинную историю. Почему каждому элементу, словно визитная карточка, соответствовал единственный и неповторимый спектр, состоящий из индивидуального набора цветных полос? Да и не только цветных, видимых человеческим глазом, но и из полосок в ультрафиолетовом и инфракрасном, невидимых глазом, диапазонах…
Со времени открытия Кирхгофом и Бунзеном спектрального анализа ученые многое узнали о спектрах, проделали большую работу. Но все их выводы держались на законах, выведенных чисто эмпирическим путем, то есть непосредственно из опыта.
Например, оптики обнаружили, что в линейчатом спектре линии группируются в отдельные серии. В каждой серии интенсивность линий уменьшалась к концу, который характеризовался большим сгущением линий.
Одной из самых первых серий, изученных учеными, была серия в видимой части водородного спектра — четыре голубых линии с разными длинами волн.
В 1885 году швейцарский школьный учитель Иоганн Якоб Бальмер (1825—1893), сопоставляя длины волн этой спектральной серии, вывел формулу, которой они подчинялись.
Самым замечательным оказалось то, что длины волн других спектральных серий водорода, обнаруженных позже, так же прекрасно укладывались в формулу Бальмера. Потом, также эмпирически, были построены формулы для длин волн спектральных линий других элементов. Формулы были готовы, но понять происхождение спектральных линий, исходя из модели атома Томсона, никто не мог. Было совершенно очевидно, что наблюдаемое явление требует квантового подхода…
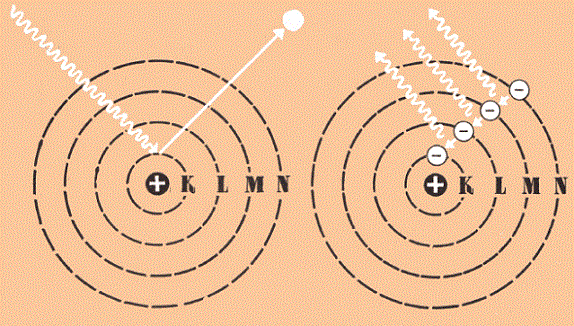
Схема боровских переходов электрона с одной орбиты на другую
И вот в такой-то обстановке и появились теоретические статьи Бора. В предисловии он писал: «В настоящей статье обсуждается механизм связывания электронов положительным ядром в его отношении к теории Планка. Она имеет целью показать, что с этой точки зрения возможно объяснить простым образом закон линейного спектра водорода».
Помните, мы с вами обсуждали понятие непрерывности и дискретности и я приводил в качестве примера банку с водой и коробку с кубиками?..
Так вот, главным в гипотезе Бора было предложение считать, что энергия электрона может меняться только порциями-квантами. Причем до тех пор, пока электрон обращается по одной и той же «разрешенной», или стационарной, орбите, он не теряет энергию вообще, не излучает. И лишь под воздействием какой-либо силы извне, получив толчок и перескочив с одной разрешенной орбиты на другую разрешенную, находящуюся ближе к ядру, он теряет квант энергии, излучая его в пространство. Впрочем, Бор сам в заключении третьей части своей статьи перечисляет допущения, введенные им для решения поставленной вначале перед собой задачи. И эти допущения показывают, что теория Бора представляла собой смесь старых классических и новых квантовых представлений. Это обстоятельство смущало не только критиков, но, в глубине души, и самого автора статьи.
Но на первых порах теория Бора оказалась во многом чрезвычайно удачной. Для атома водорода она предсказала, например, его размеры.
По вычислениям Бора получалось, что испускаемые электронами кванты точно соответствуют излучению тех длин волн спектра водорода, которые получались по формулам Бальмера и соответствовали эксперименту. Более того, теория Бора правильно предсказала, что спектры атомов с одним электроном — например, единожды ионизованного гелия, дважды ионизованного лития и так далее — должны были иметь характер, аналогичный спектру водорода.
Атом Резерфорда—Бора
Так оно и оказалось. Но на этом успехи новой теории и закончились. Объяснить спектры более сложных атомов, обладающих большим числом электронов, теории Бора не удавалось. И это было ее серьезной неудачей.
После того как специалисты познакомились со статьями Бора, большинство их разделилось на два лагеря. Одни поддерживали молодого теоретика, другие были категорически против.
В сентябре 1913 года Британская ассоциация содействия прогрессу науки разослала всем ведущим физикам, занимающимся проблемами радиоактивности и строения атомов, приглашения на дискуссию. «Гвоздем программы» была теория Бора.
На высоком собрании присутствовали Резерфорд и его учитель Дж. Дж. Томсон, Мария Склодовская-Кюри и Лоренц, был Джинс. Нильс Бор чувствовал себя не очень уютно среди знаменитостей.
Рассказывают, что после того, как Джинс открыл дискуссию и изложил примеры применения квантовой теории для объяснения строения атома, он сказал: «Доктор Бор пришел к оригинальному и, должен добавить, убедительному объяснению законов спектральных линий». Затем Джинс посетовал, что новая теория является комбинацией из классической и квантовой физики и что выводы ее подрывали самые основы науки. «Но, — добавил он, — оправданием предложенной гипотезы могут служить ее успехи как среди части физиков, так и в проверке результатов некоторых экспериментов».
Обескураженные таким неопределенным отношением Джинса, присутствовавшие попросили Рэлея высказать свое мнение. Он со своей маленькой лабораторией много сделал в исследовании такой большой проблемы, как излучение, ему, как говорится, и карты в руки. Лорд Рэлей поднялся с места и ответил так: «В дни молодости я сделал для себя некоторые важные выводы, которым стараюсь следовать и поныне. Один из них заключается в следующем: если тебе перевалило за шестьдесят, старайся не высказываться по поводу новых идей! Несмотря на то, что мне сегодня нелегко следовать этому правилу, я все же предпочел бы не принимать участия в дискуссии».
Но были среди противников новой теории люди и не столь деликатные, как лорд Рэлей. Впрочем, и они, искренне преданные науке, были уверены, что защищают ее основы, яростно отвергая все выводы новой теории вообще. Атомная физика рождалась слишком революционной. Игнорировать ее уже никто не мог, но сторонники классики продолжали не соглашаться с ней еще много лет спустя.
Известный советский физик Я. И. Френкель уже в 1925 году писал из Геттингена, где он проходил стажировку: «…В середине июня собирается приехать Эренфест со свитой своих сотрудников и в том числе с цейлонским попугаем, обученным произносить следующую фразу: «Aber meine Herren, das ist keine Physik» («Но, господа, это не физика»). Этого попугая Эренфест выдвигает в председатели на предстоящих дискуссиях о новой квантовой механике».
Пауль Эренфест (1880—1933) был в те годы известным физиком-теоретиком. После окончания Венского университета долго работал в Петербурге, потом в Лейдене. Неоднократно приезжал в нашу страну после революции. Развитие советской теоретической физики тесно связано с именем Павла Сигизмундовича, как называли его русские друзья. К интересующим его вопросам относились многие разделы квантовой теории и статистической механики. Не было, пожалуй, ни одной острой проблемы современной ему физики, по которой он не высказался бы тем или иным путем, не затеял дискуссии, не вовлек бы в нее окружающих. Превосходный организатор, обаятельный и жизнерадостный человек, он обладал необычайно развитым критическим даром. И благодаря ему оказывал очень большое влияние на других физиков.
Павел Сигизмундович был дружен со многими людьми, но особенно он любил Эйнштейна, Бора и Иоффе. И всячески старался защищать первых двух от обвинений в необоснованном новаторстве.
Рассказывают, что, когда однажды Эрепфеста спросили, чем отличаются Эйнштейн и Бор от остальных физиков, он ответил, что оба отличаются большой индивидуальностью, но тем не менее обладают рядом общих черт, отличающих их от «обыкновенных» физиков. «И Эйнштейн, и Бор исключительно хорошо знают классическую физику, они, так сказать, пронизаны классическим знанием. Они знают, они любят, они чувствуют классику так, как не может этого делать обыкновенный физик. Меньше всего они готовы признать новое только потому, что это — новое. Скорее их можно назвать консерваторами — с такой бережностью они относятся к классическим объяснениям, к каждому кирпичику здания классической физики. Но для них новые вещи являются необходимостью потому, что они хорошо знают старое и отчетливо видят невозможность старого классического объяснения».
