Основной задачей анатомии культурных растений как вспомогательного метода в селекции является всемерное содействие ускорению селекционной работы.
Материал, прорабатываемый в селекционном процессе по каждой культуре, бывает очень большой. При анатомических исследованиях в применении к селекции необходимо бывает проверить этот громадный материал в возможно короткое время и при этом получить достаточно отчетливые результаты. В соответствии с такими требованиями со стороны селекции к анатомии растений в анатомической работе можно наметить ряд этапов.
Прежде всего на основе всестороннего изучения структуры каждого культурного растения и установления закономерности организации этой структуры необходимо уловить наиболее характерные и ценные для селекционной работы особенности строения. Затем нужно уметь выявить эти особенности строения в наиболее очевидной и легко передаваемой форме и применить к задачам селекции.
Так как в селекции имеют дело преимущественно с мелкими таксономическими единицами — с разновидностями и сортами, то найти руководящие и ценные для селекции особенности структуры часто довольно трудно. Поэтому-то и требуется всестороннее и глубокое знание строения каждого растения, основанное на тщательном его изучении. Однако нередко само направление селекционной работы может дать указания анатому, на каких особенностях структуры следует остановиться, например: при селекции льна на количество волокна, естественно, необходимо обратить внимание на количественное соотношение развития лубяных волокон и развития всего массива стебля. При селекции же льна на качество волокна следует обратить внимание на строение и размеры самих волокон.
При селекции гороха на продуктивность (урожайность) необходимо изучить строение узлов стебля, а при подборе на разваримость гороха — на строение кожуры семени, строение семядолей. Правда, направление работы селекционера может служить только общим руководящим принципом для работы анатома в контакте с селекционером — само же понимание сущности анатомических явлений и задача выявления координации их есть уже дело анатома, что и является наиболее существенным. Наряду с разработкой методов анатомических исследований в связи с селекцией анатомический анализ ряда явлений может быть контролем для работы самого селекционера. Известно, что при селекции нередко пользуются зрительными впечатлениями, особенно в отношении окраски различных органов, пигментации их. Однако пигментация органа при рассмотрении того или другого органа снаружи совершенно не дает истинного представления о своей сущности и локализации. Только анатомический анализ может показать, какова природа пигментов, их сочетание и распределение по тканям. Так, например, семена многих растений бывают бурой окраски. Поверхностное исследование таких семян не дает возможности определить, какому из бурых пигментов обязана окраска того или другого семени, где залегает пигмент. Анатомический анализ обнаруживает, что у одних семян бурая окраска обусловлена продуктами разложения пигментов групп хлорофилла, а у других — групп антоцианина. Затем в семенах одних растений пигменты расположены в полости клеток, в семенах других они пропитывают только их оболочки. Пигментации семян в растениеводстве придают большое значение: на окраске семян нередко в значительной доле строится классификация рас или сортов культурных растений. Иногда характер пигментации служит диагностическим признаком для определения хозяйственно ценных качеств семенной продукции. Так, качество масла, получаемого из семян сои с бурыми пятнами на кожуре, будет несколько иным, чем из семян того же сорта, но без пятен.
Проростки ряда растений окрашены антоцианином. Антоцианиновая окраска, размещение ее по органам проростка, присутствие или отсутствие ее также используются в растениеводстве как признаки, характеризующие тот или другой сорт культурного растения, как средства, помогающие дифференцировать близко стоящие формы растений. На окраске антоцианином проростков картофеля основано разделение некоторых сортов этого растения. Пигментирование антоцианином проростков имеет даже систематическое значение для разделения более крупных систематических групп. Конечно, в систематике не одна лишь окраска антоцианином служит для дифференциации разновидностей или рас; пигментация вносит лишь дополнительные, но иногда весьма важные штрихи в классификацию. Анатомический анализ показывает, что даже среди окрашенных проростков различных растений существуют серьезные и принципиальные различия в сущности пигментации. Этим анатомия еще больше подчеркивает значение пигментации.
Приведем пример в подтверждение ценности анатомического анализа для установления тонких систематических различий. Проростки многих Горохов, происходящих из Абиссинии и Афганистана, окрашены антоцианином. При выращивании их в южных районах Союза это окраска бывает особенно интенсивной. В листьях Горохов из Абиссинии клетки с антоцианином принадлежат мезофиллу листа, а у гороха из Афганистана содержащие антоцианин клетки находятся только в эпидермисе. Из этого следует, что одного установления наличия пигмента в органе совершенно недостаточно. Это в особенности важно по отношению к работе селекционера, когда имеют дело с тонкими таксономическими различиями (с различными расами), с выявлением сортового разнообразия.
Необходимость анатомии для селекционной работы доказана. Доказательством этого служит ряд анатомических работ, периодически предпринимаемых с целью содействия селекции. Особенно выделяются работы над текстильными лубо-волокнистыми растениями — льном и коноплей.
В начале параграфа было указано, что одной из задач анатомических исследований в применении к селекции является ускорение селекционной работы, повышение ее темпов. Эту задачу анатомия должна разрешить в двух направлениях: с одной стороны, следует выработать достаточно эффективные методы анатомических исследований, дающие возможность пропустить большое количество материала, с другой — методы должны быть настолько просты, чтобы быть доступными для большого числа работников и в лабораториях, не имеющих возможности приобретать дорогостоящего оборудования. Так как анатомические работы с текстильными лубо-волокнистыми растениями в связи с их селекцией получили уже некоторое распространение, то лучше всего именно на них показать примеры возможной, рационализации и упрощения методики анатомических исследований.
Как известно, для анатомического исследования прежде всего необходимо приготовить из объекта исследования соответствующий препарат. Анатомический препарат представляет собой обычно тонкий срез того или другого органа или части его, настолько тонкий, что его можно рассматривать в проходящем свете, идущем от зеркала микроскопа. Чтобы выделить те или другие ткани среза, его обычно окрашивают специфическими красителями, которые воспринимаются только определенной тканью или группой тканей в силу специфических свойств оболочек или содержимого клеток. Так, например, краситель сафранин весьма хорошо окрашивает одревесневшие оболочки и очень слабо неодревесневшие, целлюлозные. Есть красители, особенно хорошо окрашивающие ядро, крахмал и т. д.
На те или другие вещества, находящиеся в растении, есть специальные реактивы, дающие красочные реакции. К числу таковых принадлежит, например, йод, при действии которого крахмал приобретает синюю или фиолетовую окраску вследствие образования особого соединения крахмала с йодом.
Итак, приготовление препарата распадается в основном на два раздела: получение срезов и окраска их.
Очень часто для анатомического исследования стебли льна поступают сухими. С таких стеблей нельзя получить срезы, удовлетворительные для изучения структуры. Сухие стебли хрупки, препараты из них получаются сморщенные, с деформированными клетками и тканями. Сухие участки стеблей необходимо размягчить. Можно размягчение и окраску объединить, для чего нужные участки стеблей льна длиной 2—3 см помещают в плотно закрывающейся банке в смесь спирта с глицерином, разбавленную водой и окрашенную сафранином. Банку ставят в термостат при температуре 40—45° С. В такой окрашенной сафранином смеси спирта с глицерином, в тепле участки стеблей льна не только размягчаются, но и прокрашиваются. Все ткани постепенно и равномерно разбухают, расправляются, одревесневшие оболочки ярко окрашиваются, резко выделяются почти неокрасившиеся лубяные волокна и паренхима коры стебля. Затем приготовляют срезы.
Обычно для контроля при селекционных работах бывает достаточно поперечных срезов стеблей; продольные разрезы необходимы только для более углубленного изучения особенностей структуры стебля. Конечно, очень хорошие срезы, в смысле их тонкости и ровности, можно приготовить обычным ручным способом, но для получения вполне правильных срезов одинаковой толщины и с безукоризненно ровной поверхностью необходимо применять микротом. Микротом в значительной мере способствует ускорению работы, особенно в применении к селекционным целям. При селекционных работах необходимо иметь дело с многочисленными повторениями одной и той же линии для получения наиболее достоверных результатов, в силу чего и в анатомических исследованиях, проводимых в связи с селекцией, нередко необходимо получить срезы с нескольких стеблей. Для резки микротомом участки стеблей следует залить в парафин, целлоидин или еще в какое-либо другое достаточно твердое и пластичное при обыкновенной комнатной температуре вещество. При этом вместо одного участка стебля льна можно залить несколько, например, пять однородных участков с пяти растений. Тогда одним движением микротомной бритвы будет получено сразу пять одинаковых срезов, которые можно сравнить между собой. Применение микротомов значительно сокращает время работы и, следовательно, удешевляет стоимость производства ее, а также повышает качество работы.
К числу наиболее трудных процессов анатомической работы принадлежит передача анатомических картин, их воспроизведение. Зарисовывание сложной структуры стебля требует много времени и специального навыка. Зарисовывание при анатомических исследованиях, конечно, необходимо, но при проработке обширного сравниваемого материала зарисовывание может сильно замедлить самый процесс работы или потребует большого числа работников. Ускорить дело может микрофотография. При этом вместо дорогих, громоздких, требующих особого помещения микрофотографических аппаратов для серийных анатомических исследований можно пользоваться простым устройством, состоящим из микроскопа и сильной электрической лампы.
Вместо пластинок удобнее пользоваться фотобумагой. Такой метод получения отпечатков непосредственно на фотобумагу называется методом бумажных негативов. Этим методом получают обычно моментальные снимки, снимая потом с негатива позитивное изображение. Для анатомических исследований негативные изображения так же пригодны, как и позитивные. Многие микрофотографии, помещенные в этой книге, исполнены методом бумажных негативов.
Изображение препарата (то место его, которое желательно отпечатать) отбрасывается на несколько секунд в темной комнате на фотобумагу достаточной светочувствительности, а затем идет обычное проявление отпечатка. Метод бумажных негативов в значительной степени удешевляет работу и ускоряет ее. Проявление пластинок, затем печатание с них требует, несомненно, больше времени, чем получение на бумаге негатива, вполне пригодного для анатомических снимков.
Повторные снимки так же легко получить с препарата, как и первые. Но кроме того, метод, основанный на приспособлении для микрофотографии одного лишь микроскопа, дает возможность легко менять увеличения.
Пользуясь вышеописанным методом микрофотографии, можно приступить к массовому определению достоинства исследуемого сорта льна с точки зрения выхода волокна, т. е. к количественно-анатомическим определениям.
Оценку льна с точки зрения выхода волокна производят обычно достаточно известным технологическим способом. Для этого- льняную солому подвергают специальной мочке и трепке, освобождая таким путем лубяные волокна от костры. Отношение веса высушенного должным образом волокна к весу соломы до мочки будет характеризовать выход волокна, его урожай. Анатомический метод оценки льна по выходу волокна в отношении сравниваемых элементов стебля льна должен также следовать методу технологическому, но вместо определяемых при технологическом анализе весовых отношений или отношений массы следует пользоваться установлением отношений площадей тех же самых элементов, слагающих стебель льна. В этом направлении различные исследователи стремились выработать методику определения процентного содержания волокна в стебле льна анатомическим способом. Мы не будем здесь излагать историю развития методики и остановимся лишь на последнем методе, выработанном в анатомической лаборатории Всесоюзного института растениеводства.
Прежде чем приступить к анатомическому исследованию, необходимо найти в стебле льна такое место, срезы с которого были бы достаточно характерны для всего растения и представляемого им исследуемого сорта, а также пригодны для сравнения. Стебель льна-долгунца, как известно, довольно длинный, а приготовление срезов со всех его участков весьма затянуло бы работу. Определение более рационального места для исследования представляет одну из наиболее трудных задач в анатомических исследованиях в связи с задачами селекции. После целого ряда работ было установлено, что наиболее равномерной структурой у льна-долгунца (с обычной, так называемой хозяйственной густотой посева) обладает средняя часть технически ценной длины стебля на относительно большом расстоянии. Следовательно, если провести поперечный разрез стебля в каком-либо месте средней трети технически ценной длины его, то этим срезом можно воспользоваться для определения процентного отношения массы лубяных волокон к общему массиву поперечника стебля, и полученные результаты могут быть характерны для большей части длины стебля растения, выросшего при нормальной в хозяйстве густоте посева.
Как показывает рисунок, сердцевина в стебле льна ко времени его созревания в целости не сохраняется: в центре стебля находится полость, образовавшаяся вследствие разрушения сердцевины, причем границы полости неправильные.
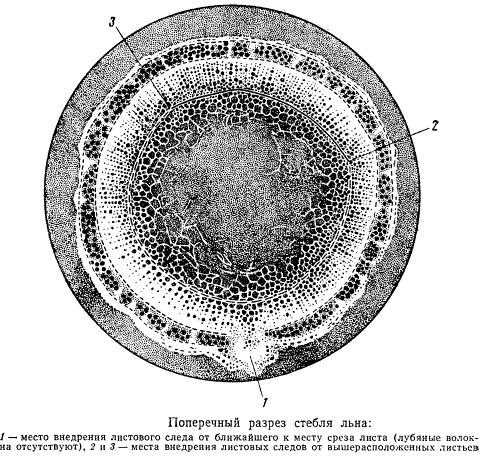
Полость в сердцевине обычно образуется в средней по длине части стебля, наиболее, как уже отмечалось, пригодной для определений. Необходимо эту полость и вообще сердцевину исключить из определений, тем более что при технологическом анализе сердцевина, как рыхлая, легкая и непостоянных размеров ткань, имеет мало значения; кроме того, сердцевина так же, как и паренхима коры, во время мочки разрушается и для некоторых определений имеют значение только лубяные волокна и древесина. Итак, для более точного определения процентного содержания волокна, отвечающего технологическому анализу, в стебле льна необходимо определить внутреннюю границу древесины (вторичной ксилемы).
Известно, что ксилема (древесина) в стебле высшего травянистого растения состоит из внутреннего участка, называемого первичной ксилемой, и из более наружного основного массива — вторичной ксилемы. Весь стебель травянистого двудольного растения построен из более или менее хорошо друг от друга отличимых сосудисто-волокнистых пучков, в состав которых входит и ксилема. Если в каждом пучке на изображении поперечного разреза стебля льна отметить те места, которые заняты участками первичной ксилемы, и соединить эти пункты линией, то между центральным цилиндром и сердцевиной получится естественная граница. Первичная ксилема является элементом, лежащим наиболее глубоко внутри центрального цилиндра. Таким путем исключается сердцевина. Теперь как будто бы дело остается лишь за планиметром: обвести ксилему по внутренней и наружной границам ее, между сердцевиной и камбием, обвести границы площади, занимаемой лубяными волокнами, и определить отношение полученных величин. Для массовых предварительных определений этого может быть вполне достаточно, но при соблюдении строгой точности в исследовании и подробной передаче структуры стебля такими определениями ограничиться нельзя.
Если просмотреть ряд поперечных разрезов стебля льна, невольно можно заметить, что массив лубяных волокон расположен по окружности каждого среза не совсем равномерно. Например, на рисунке видно, что в одном месте среза волокон совсем не имеется (на рисунке отмечены цифрой 1), в другом, почти противоположном ему, волокна имеются (на рисунке отмечено цифрой 2), но их меньше, чем в соседних участках того же самого поперечного разреза. Места полного отсутствия или малого количества лубяных волокон в стебле льна на поперечных разрезах его — это места внедрения в центральный цилиндр
стебля так называемых листовых следов. Следовательно, пользоваться всем поперечным срезом для определения процентного отношения площади, занимаемой лубяными волокнами, к площади ксилемы не вполне рационально, вследствие чего следует пользоваться лишь теми местами поперечного разреза, где структура центрального цилиндра наиболее равномерна. Таким участком стебля с равномерной структурой будет сектор, расположенный против места внедрения листового следа листа, прикрепленного в ближайшем к срезу узле. Этот сектор оказывается заключенным между листовыми следами, идущими от 2-го и 3-го из вышерасположенных над срезом листьев. Оба листовых следа легко различимы, а при внимательном рассмотрении и некотором знании анатомии стебля льна — безусловно всегда. Угол сектора, заключенного между ними, равен 130° с небольшими отклонениями в ту или другую сторону. Определение процентного отношения площади, занимаемой лубяными волокнами, к площади ксилемы в очерченном таким путем секторе поперечного среза стебля льна будет наиболее соответствовать действительным отношениям в выходе волокна. Это показали специальные исследования.
Все описанное выше относится к определению количества лубяных волокон стеблей льна того или другого исследуемого сорта этого материала по выходу волокна. Значительно труднее оценить качество волокна анатомическими методами. Однако оценка его хотя бы в самых общих чертах была бы весьма полезной для селекционной работы. Имея какой-либо определенный показатель качества волокна, селекционер с достаточной долей объективности мог бы быстро провести браковку элит еще на ранних стадиях работы, не прибегая к повторным посевам и размножению элитного материала, требующим много времени и средств. Изучение различного материала по льнам показало, что для анатомического разграничения стеблей льна с хорошим и плохим качеством волокна могут быть намечены предварительные пути. При рассмотрении срезов стеблей льна, особенно базальной их части, иногда можно встретить лубяные волокна ненормальной структуры. Полости таких волокон чрезвычайно сильно разрастаются, волокна явно патологической структуры и несомненно плохого качества в текстильном отношении. Параллельно с патологическим изменением лубяных волокон происходят некоторые изменения и в ксилеме, заключающиеся в том, что оболочки либриформа получают ненормальные утолщения, состоящие из гемицеллюлозы.

При этом патологические изменения в лубяных волокнах обязательно сопровождаются образованием утолщений в либриформе, как бы мало патологических волокон ни было. Так как образование утолщений либриформа связано с появлением среди лубяных волокон элементов, ухудшающих качество этих волокон, то можно предположить, что при наличии или отсутствии либриформа с гемицеллюлозными утолщениями качество волокна будет соответственно меняться. Конечно, показатели эти будут иметь значение лишь тогда, когда они встречаются в средней части стебля или вообще по всей зоне стебля, технически ценной для текстильной промышленности. Весьма существенное значение имеет учет количества патологически изменившихся волокон, дающих возможность в той или другой мере влиять на качество продукции волокна.
Таким образом, детали структуры лубяных волокон стебля льна, выявляющие хозяйственно ценные признаки их, координационно связаны с деталями структуры соответствующих участков ксилемы. Эти признаки зависят от ряда условий. Структура — пластична, в чем должны быть убеждены как анатомы, так и селекционеры.
По мере развития и роста растительного организма структура его переходит из одной фазы в другую. Например, первичная ксилема стебля хорошо выражена в молодом состоянии организма, а к зрелой стадии она нередко исчезает. К зрелости меняется также структура коры и сердцевины. Закономерная изменчивость в строении органов растения указывает на то, что при подборе материала для анатомических исследований в помощь селекционной работе нужно быть очень осторожным и собирать вполне однородный материал.
Осторожное отношение к сбору материала необходимо и вследствие того, что один и тот же орган по длине своей построен неодинаково: верхушка стебля построена несколько иначе, чем основание стебля. Даже ветки, прикрепленные на различных уровнях на одном и том же стебле, имеют различную структуру. То же самое можно сказать и относительно листьев. Структура листьев растений, высеянных в различные сроки одного и того же вегетационного периода, может различаться иногда довольно значительно не только количественно, но и качественно. Если у растения выщипать ветки в ранней стадии их появления (прищипка), то стебли этих растений могут довольно сильно разрастись в толщину; происходит гипертрофия стебля.
Структура есть отражение всех идущих в растении биохимических процессов. В результате некоторых процессов, их специфического направления, в растениях нередко вырабатываются различные вещества, обладающие специфическими свойствами: каучук, опий, эфирные масла и др. В селекции нередко идет работа на накопление определенных качеств. Так, например, можно указать на проблему создания наиболее каучуконосной формы гваюлы. Возможно ли связать какой-либо анатомический признак с существованием большой каучуконосности и руководствоваться им наравне с химическим анализом или в помощь ему при селекции? Анатомические исследования над гваюлой, различными селекционными сортами ее показали, что это возможно. Сравнение структуры стеблей гваюлы с хорошим и плохим выходами каучука обнаруживает у богатой каучуком гваюлы (обилие так называемых резиновых каналов как в коре, так и в Сердцевине. У разновидностей же гваюлы с плохим выходом каучука резиновых каналов в коре очень мало, они ничтожного диаметра, а в сердцевине таких каналов почти совсем нет. Хотя каучук у гваюлы содержится преимущественно не в каналах, а в паренхимных клетках, рассеянных в различных местах по массиву стебля, и в эпителии, ограничивающем резиновые каналы, количество и степень развития самих каналов каким-то путем координационно связаны с большим накоплением каучука. Кроме того, в стеблях гваюлы с хорошим выходом каучука весьма плохо одревесневают ближайшие к камбию участки ксилемы. В стеблях же гваюлы с плохим выходом каучука одревеснение вторичной ксилемы равномерно идет до границы камбия. Следовательно, между хорошим и плохим каучуконосами анатомические различия достаточно выражены и определенны.
Также и при селекции на накопление в растениях другого ценного вещества — опия в маке — возможны определенные анатомические коррективы. В каждой разновидности опийного мака имеется опий, но путем долголетнего культивирования выработались специальные опийные расы. Такие высокоопийные расы маков известны в Турции, Иране, Индии и Китае. В СССР известны семиреченские расы. Опий собирается обычно с коробочек, не вполне дозревших, после нанесения на них особых надрезов, но можно его получать и из листьев. Содержащие опийный секрет млечные трубки входят в состав флоэмной части сосудисто-волокнистых пучков как коробочек, так и листьев.
Для анатомической сравнительной характеристики форм маков, различающихся содержанием опия, следует, по-видимому, искать какие-либо отличия в строении пучков, пронизывающих стенки коробочки, и пучков, составляющих жилки листа. Исследование показало, что просвет млечных трубок в коробочках опийных маков значительно крупнее и число их больше, чем млечных трубок в коробочках масличных сортов, отличающихся слабой опийностью. Следовательно, по просвету млечных трубок и по числу их можно контролировать селекционную работу. Кроме того, поскольку в каждом сосудисто-волокнистом пучке коробочки мака есть несущие опий млечные трубки, достаточно установить густоту сети пучков на определенную площадь стенки коробочки, чтобы иметь возможность судить о степени опийности мака. Специальными исследованиями было установлено, что высокоопийные маки имеют сеть пучков в стенке коробочки значительно более густую, чем маки масличные. Следует отметить, что для таких определений необходимо приготовлять срезы не только с вполне определенного для всех исследуемых коробочек одного и то же места стенки, но и одинаковой толщины. Очень тонкими срезами пользоваться нельзя. Лучше всего срезы толщиной 0,5 мм. Если такие срезы выдержать некоторое время в хлоралгидрате, то они станут совершенно прозрачными, с проступающими в них жилками (пучками), образующими более или менее густую сеть.
Всякая селекция обязательно должна соответствовать определенном климатическим условиям. Известно, что сорта, хорошие для Одних условий, оказываются совершенно негодными для других. Универсальных сортов или рас культурных растений, пригодных для всяких климатов, пока еще не имеется. Поэтому испытание сортов в различных климатических условиях, анализ качеств этих сортов имеют для селекции большое значение. Результаты анализа должны указывать направление работы селекционера по созданию сорта, пригодного для того или другого района.
Большое значение для уяснения характера реагирования культурного растения на различные модификации климатических условий имеют посевы семян одного сорта в различных географических зонах. Анатомия в этой области может быть хорошим подспорьем. Анатомический анализ семян, плодов и вегетативных органов растений может дать большой материал для синтетической селекции и служить контролем.
Детальный анализ пигментации, определение природы, состояния, залегания и распределения пигментов в различных органах может разъяснить некоторые особенности, характеризующие как исходный, так и конечный материал. Например, семена многих бобовых имеют бурую окраску. Понятие бурой окраски отличается некоторой неопределенностью. Причины же, обусловливающие бурую окраску, как уже говорилось раньше, могут быть весьма различны. Иногда даже никакого бурого пигмента в кожуре семян не имеется, а окраска семян при рассматривании их с поверхности кажется бурой. В таких случаях бурая пигментация создается вследствие смешения нескольких пигментов и отражения света, проходящего через эти пигменты, белыми внутренними слоями кожуры. Так, бурая окраска семян полукультурной сои слагается из зеленого пигмента пластид, розового антоцианина вакуолей и желтого пигмента, пропитывающего оболочки клеток. Все эти пигменты локализованы в палисадном эпидермисе кожуры семян. Подстилающая же палисадный эпидермис ткань совершенно лишена пигментов, но состоит из клеток, весьма рыхло соединяющихся друг с другом с большими межклетниками. Как межклетники, так и полости клеток в зрелых семенах наполнены воздухом, и поэтому вся рыхлая ткань имеет снежнобелый цвет и обладает сильной отражательной способностью. Из всего этого видно, что базироваться на особенностях окраски семян в селекции без предварительного анализа сущности этой окраски нельзя, так как в этом случае можно прийти к неправильным выводам.
Задачи селекции и вообще растениеводства многообразны. Селекционеру необходимо создавать не только высокоурожайные сорта, но и сорта с высоким качеством продукции; необходимо селекционировать формы, стойкие против различного рода неблагоприятных обстоятельств. Сорта, культивируемые в одних районах, должны быть засухоустойчивыми, в других — жароустойчивыми или холодоустойчивыми или, наконец, стойкими против специфических болезней и паразитов. В этой области анатом должен работать в контакте не только с селекционером, но и с физиологом и фитопатологом.
Особое значение, судя по некоторым наблюдениям, должно иметь во время засухи или заморозков состояние пластид в растениях. Если пластидный аппарат при неблагоприятных обстоятельствах останется неповрежденным или поврежденным настолько незначительно, что при наступлении нормальных условий произрастания нормальное состояние и функции пластид могут восстановиться, то есть много шансов, что растение не только останется живым, но и будет хорошо плодоносить. Такие растения устойчивы. Конечно, упрощать явление устойчивости нельзя. Устойчивость есть результат совокупности весьма сложных соотношений, слагающихся в различных условиях неодинаково. Но включить изучение состояния пластидного аппарата при анализе работы селекционера на некоторые виды устойчивости необходимо.
Итак, в связи с общими задачами культурного растениеводства анатомии растений должно быть отведено подобающее ее значению место. Растительная анатомия может быть не только подсобной дисциплиной: у анатомии есть проблемы, разрешение которых входит в цикл вопросов общего познания растений и их свойств. При изучении анатомии растений следует руководствоваться положением, которого и мы стремились придерживаться: «Структура растительного организма есть процесс, причем структура нормального растения — процесс организованный».
Несомненно, физиологической анатомии предстоит большое будущее в связи с задачами растениеводства. Но чтобы развиваться и процветать, физиологическая анатомия растений не должна отрываться от физиологии растений, теснейшим образом связанной с агрономией. Наиболее плодотворным направлением исследования следует признать сочетание анатомического анализа с экспериментом.
Итак, анатомический анализ в сочетании со специально направленным экспериментом является могучим орудием при решении ряда важнейших вопросов морфологии, филогении, экологии, растениеводства и прочих биологических дисциплин.
