Процесс кристаллизации состоит из двух этапов — зарождения кристаллов и их роста. Зарождение кристаллов происходит при упорядочении группы молекул воды и сохранении этой структуры, которая затем начинает укрупняться путем вовлечения в нее все новых молекул воды. Скорость этих двух этапов и характеристику полученной кристаллической системы можно контролировать.
Особенно сложен первый этап — формирование первоначальных ядер кристаллов, так как необходимо, чтобы сформировалась кристаллическая решетка и образовался миникристалл, который был бы в равновесии с жидкой фазой. Затруднение связано с подвижностью молекул воды. Вот почему при понижении температуры перед началом кристаллообразования процесс проходит через так называемую стадию переохлаждения: если температура появления первых кристаллов около —2,5°С, то при понижении температуры данного раствора она достигает значения ниже —25°С без формирования кристаллов льда. Этот процесс переохлаждения, однако, не оказывает влияния на качество замороженных продуктов, в отличие от процесса кристаллообразования.
Существует 2 типа формирования кристаллов льда — гомогенный и гетерогенный. Первый характерен для чистой воды и не имеет практического значения, так как применительно к продуктам и микроорганизмам речь идет о замораживании сложных растворов.
Гетерогенное, или называемое еще каталитическим, формирование ядер кристаллов льда характерно для пищевых продуктов и живых систем. Оно состоит в формировании ядер по соседству с растворенными в них частицами, в формировании поверхностного кристаллического слоя на этих частицах или на стенах сосуда, в котором находится раствор, который будет подвергаться замораживанию. В этих случаях переохлаждение происходит в значительно меньшей мере.
Когда начинается кристаллизация, дальнейшее понижение температуры ведет к непрерывному повышению скорости кристаллообразования. Молекулы воды из жидкой фазы прикрепляются к сформированным ядрам кристаллов, и таким способом осуществляется процесс роста кристаллов. Молекулы воды с термодинамической точки зрения предпочитают этот процесс процессу формирования новых ядер кристаллообразования.
Скорость кристаллообразования в растворе определяется скоростью массо- и теплообмена. В процессе кристаллизации молекулы воды движутся от жидкой фазы к стабильному состоянию на поверхности кристалла, а молекулы растворенных веществ диффундируют в обратном направлении. Так как молекулы воды мелкие, легко подвижные и их много, они не могут играть решающей роли в скорости роста кристаллов льда. Это может произойти в конце процесса замораживания, когда вязкость среды большая, молекул воды мало и их подвижность понизилась из-за низкой температуры.
Принято считать, что лимитирующую роль в скорости кристаллообразования и роста кристаллов играет перенос теплоты. Это легко понять, если иметь в виду большую скрытую теплоту кристаллообразования. Кроме того, в пищевых продуктах теплообмен осуществляется прежде всего путем теплопроводности, а не путем конвекции. Скорость роста кристаллов будет увеличиваться с увеличением скорости отнятия теплоты.
Связывая механизм роста кристаллов в зависимости от теплообмена с механизмом образования ядер кристаллов при переохлаждении растворов, можно сделать вывод о том, что при быстром охлаждении образуется много ядер и соответственно много мелких кристаллов, а при медленном охлаждении — мало ядер, но кристаллы крупные.
Безусловно, на этот процесс оказывают влияние и другие факторы. Например, в мясе рыбы, которая перед замораживанием не достигла состояния окоченения, размеры кристаллов будут отличаться от размеров кристаллов в мясе, прошедшем эту стадию, при одной и той же скорости замораживания.
Рекристаллизация — другое явление, характерное для этого метода консервирования. Она является результатом нестабильного состояния сформированных кристаллов. Из-за этого кристаллы подвергаются метаморфическим изменениям, известным под общим названием рекристаллизации, которая включает любое изменение в количестве, размере, форме, ориентации и т. д. Рекристаллизация наблюдается во многих пищевых продуктах и во льду, полученном из чистой воды. Ее скорость зависит от вида продукта и температуры. С понижением температуры скорость рекристаллизации уменьшается. Наличие растворенных веществ тоже понижает скорость рекристаллизации. Вот почему рекристаллизация в чистом льде протекает при —96°С, а в тканях — при —18°С.
В соответствии со вторым законом термодинамики рекристаллизация — результат стремления системы достичь состояния равновесия, при котором свободная энергия минимальна и наступило выравнивание химического потенциала между всеми наличными фазами в системе. Свободная энергия уменьшается выравниванием размера и формы реальных кристаллов.
Основной механизм рекристаллизации в пищевых продуктах основывается на флуктуации температуры, что является причиной миграции водяных паров с поверхности кристаллов, имеющих более высокую температуру, к поверхности кристаллов с низкой температурой. Рекристаллизацию можно уменьшить поддержанием возможно более низкой и более постоянной температуры в камерах хранения замороженных продуктов.
Значение для качества готовой продукции, а также для гибельного воздействия замораживания на микроорганизмы имеет локализация кристаллов льда в тканях и клеточных субстанциях. Медленное замораживание (скорость охлаждения 1 °С/мин) растительных и животных тканей, клеточных суспензий (микроорганизмов, красных и белых кровяных телец и т. д.), как правило, является причиной протекания внеклеточной кристаллизации. Это явление наблюдается и при медленном замораживании мяса трески перед наступлением окоченения и при повторно замороженной мускулатуре. Внеклеточное кристаллообразование характеризуется формированием больших кристаллов, большой диссоциацией воды.
Когда охлаждение происходит очень быстро (замораживание при низкой температуре), кристаллы внутри и вне клеток распределены очень равномерно. Чем больше размеры замораживаемых клеток, тем выше должна быть скорость охлаждения, чтобы кристаллы внутри и вне клеток распределились равномерно. Равномерное распределение кристаллов обеспечивает более высокое качество продукта.
Характерно, что даже и при наиболее высоких скоростях охлаждения кристаллизация начинается в первую очередь в межклеточных пространствах.
В результате постепенного и непрерывного замораживания воды в тканях постоянно повышается концентрация растворенных компонентов в незамерзшей воде. В определенный момент, характерный для каждого компонента, наступает концентрация насыщения, и он начинает кристаллизоваться вместе с водой. Это состояние, когда кристаллизуются вода и данный компонент и существует равновесие между кристаллизовавшимися компонентом и водой, известно под названием эвтектической, или криогидратной, точки. Каждое растворенное вещество имеет такую характерную точку: CaCl2 — 55°С; К2СО3 — 36,5; NaCl — 21,3; сахароза — 14; глюкоза — 5; Na2CO3 — 2,1; фосфаты натрия и калия от —0,5 до —17,2°С.
Максимальное количество льда образуется, когда достигается самая низкая эвтектическая точка, т. е. температура, при которой последняя субстанция переходит в эвтектическое состояние («конечная эвтектическая температура»). Для мороженого и белка яйца эта конечная температура составляет —55 °С, для мяса она колеблется между —50 и —60 °С, для хлеба — около —70 °С. Следовательно, при используемой в настоящее время технологии все замороженные пищевые продукты имеют известное количество незамерзшей воды, которая может быть заморожена, если температура будет понижена до определенного уровня, характерного для каждого продукта.
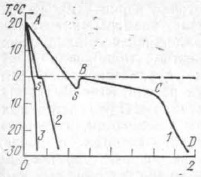
Схема замораживания
На рисунке показана типичная кривая замораживания различных пищевых продуктов при различных скоростях замораживания. Кривая 1 относится к медленно замороженному продукту. Сектор А—S соответствует охлаждению продукта до момента, при котором еще не образовались кристаллы льда. Точка S соответствует переохлаждению продукта, которая обычно на 10 °С ниже точки замерзания. Она, однако, не всегда появляется и зависит от времени измерения, места расположения термопары, чувствительности прибора, измеряющего температуру, и других факторов. В точке S начинается кристаллизация, или замораживание. Выделенная теплота кристаллизации — причина повышения температуры продукта до точки В. Сектор В—С соответствует периоду, при котором замерзает основная часть влаги, находящейся в продукте. Наклон кривой нерезкий, так как выделяющаяся теплота кристаллизации льда слабо отводится из-за медленного теплообмена. После точки С замерзает мало воды, выделяется мало теплоты и поэтому температура продукта понижается. Но и после точки С в продукте все еще остается вода, которую можно заморозить, если понизить температуру, но это экономически невыгодно.
Процент вымороженной воды зависит от температуры и продукта. В мороженом, содержащем 12,5% жиров, 15% сахара, 0,3% стабилизаторов, 10,5% сухого вещества из сыворотки и 61,7% воды при —2,5 °С не происходит формирования кристаллов, при —3,1 °С замерзает 20% воды, при 3,5°С — 30%, при —4,2°С — 40%, при —5,2 °С — 50%, при —6,8°С — 60%, при —9,5°С —70%, при —14,9°С —80%, а при — 30,2°С — 90%.
В мясе, которое содержит мало жиров, в рыбе треске, яичных белках, смеси белков и желтков (яичном меланже) степень вымораживания воды зависит от влажности и температуры.
Источник: Б.Л. Флауменбаум, С.С. Танчев, М.А. Гришин. Основы консервирования пищевых продуктов. Агропромиздат. Москва. 1986
